编者按
为帮助肝病领域临床医生和科研人员及时更新学术知识和掌握科研动向,《国际肝病》与《临床与转化肝脏病杂志》(Journal of Clinical and Translational Hepatology,JCTH)联合推出“期刊共读”栏目,每周精选1篇文献,解读亮点和摘选重点,希望对提高临床诊疗水平、启迪科研思维和提升写作能力均能有所裨益。
本期分享JCTH于9月15日在线发表的一篇论著《ABCB4突变患者的综合胆汁酸谱分析及牛磺酸结合的3α,6α,7α,12α-四羟基胆汁酸在胆汁淤积症中的预后作用》[1],该研究通过深入探究胆汁淤积症机制,分析四羟基胆汁酸(THBA)可能具有的重要表型决定价值和药用前景,为进一步的治疗和预后管理奠定了重要基础。
重点摘选
由ABCB4基因编码的多药耐药蛋白3(MDR3)是一种磷脂转运蛋白,主要表达在肝细胞的小管膜上,参与磷脂酰胆碱从肝细胞膜内向膜外的转位和小泡释放。ABCB4突变导致的MDR3蛋白缺失或严重功能障碍可引起进行性家族性肝内胆汁淤积症3型(PFIC3)。在PFIC3中,由于胆汁中磷脂酰胆碱缺乏,胆盐/胆汁酸无法与磷脂形成混合微粒,游离的胆盐通过其毒性去垢效应引起毛细胆管膜损伤,出现高γ-谷氨酰转移酶(GGT)胆汁淤积症。
胆汁酸/胆盐代谢紊乱是多种胆汁淤积性肝损害发生的重要机制。前期的研究中,研究团队通过分析胆盐外运泵(BSEP)缺陷患者和小鼠模型的胆汁酸代谢谱,发现了胆汁酸代谢的多种补偿机制,并发现了一类可能具有重要表型决定价值和药用前景的胆汁酸类型-四羟基胆汁酸(THBA)。BSEP缺陷病(肝细胞性胆汁淤积)和MDR3缺陷病(胆管性胆汁淤积)被认为是研究胆汁淤积性肝损害的两种重要模型。通过对其损伤机制的研究,有望帮助我们深入理解其他原发性/获得性胆汁淤积的机制。
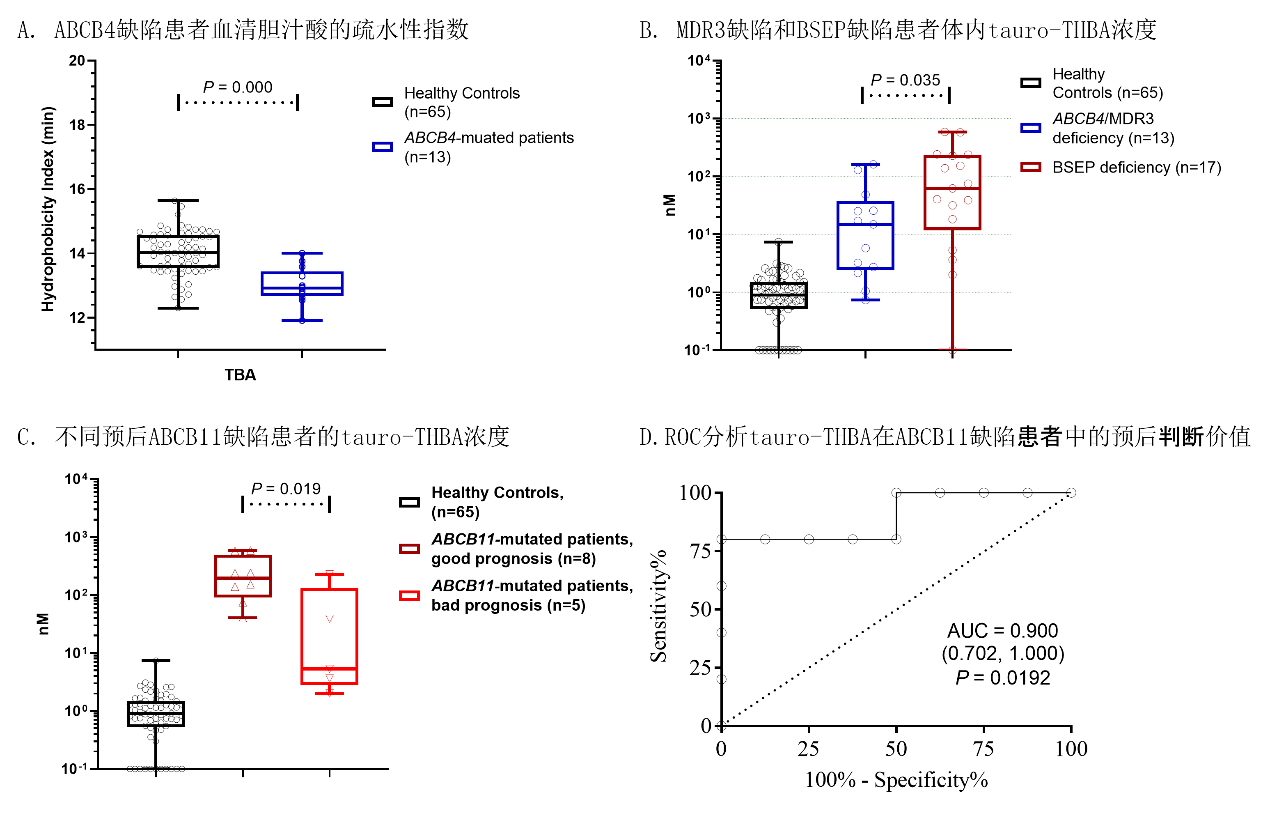
该研究中,研究团队分析了MDR3缺陷患者血清中60种胆汁酸的浓度及胆汁酸修饰过程的摩尔比,发现MDR3缺陷患者体内胆汁酸的酰胺化修饰、硫酸盐修饰和酮基化修饰过程增加,增加了患者体内胆汁酸的整体亲水性(图A)。通过与前期的BSEP缺陷患者比较,发现MDR3缺陷患者体内牛磺酸结合(tauro-)THBA的浓度低于BSEP缺陷患者(图B),提示胆汁淤积患者体内羟基化修饰在肝细胞性胆汁淤积更显著。
随后,研究者在原发性和继发性BSEP缺陷患者及不明原因低GGT患者体内初步探索了tauro-THBA的预后判断价值,结果显示血清tauro-THBA浓度可望作为生物标志物用于低GGT胆汁淤积的预后判断(图C和图D)。
亮点解读
对Mdr2 -/-小鼠模型的研究表明,一些THBA物种在静脉注射或喂养后都能刺激胆汁流动,这表明THBA有潜力作为胆汁淤积性疾病的治疗药物。最近的研究也表明,作为缓解胆汁淤积的代偿机制,产生THBA的能力会影响疾病的表型或预后。在这有限的病例中,tauro-THBA的浓度在ABCB4突变的无黄疸患者(预后良好)和失代偿性肝硬化患者或死亡/肝移植患者(预后不良)之间没有显著差异。通过增加THBA的产生或口服THBA是否可以改善ABCB4突变患者的预后,这将是一个有趣的问题。
研究者在肝病患者中发现了多种THBA异构体。由于牛磺酸-3α,6α,7α,12α-THBA是PFIC2和Alagille综合征患者中THBA的主要形式之一,因此目前的研究探讨了其预后价值,然而,由于研究者在进行研究时只能获得定制合成的牛磺酸-3α,6α,7α,12α-THBA,因此仅测量了牛磺酸-3α,6α,7α,12α-THBA,这是研究的局限性。市面上没有其他四氢氰酸盐的真正化合物。此外,tauro-3α,6α,7α,12α-THBA已被报道为PFIC2动物模型中的主要THBA。这就是为什么研究者假设它可能是PFIC2患者的生物标志物。这将是非常有趣的,知道是否有其他THBA异构体具有更高的特异性和敏感性的预后目的,并值得进一步研究。
通过以上研究,可以得出的结论是,MDR3缺陷患者体内胆汁酸的酰胺化、硫酸盐化和酮基化修饰增强,羟基化修饰增强程度低于低GGT胆汁淤积症;tauro-THBA可望作为低GGT胆汁淤积预后管理的生物标志物。
参考文献:
[1]Liu T, Wang RX, Han J, et al. Comprehensive Bile Acid Profiling of ABCB4-mutated Patients and the Prognostic Role of Taurine-conjugated 3α,6α,7α,12α-Tetrahydroxylated Bile Acid in Cholestasis. J Clin Transl Hepatol 2023. doi: 10.14218/JCTH.2023.00095. https://www.xiahepublishing.com/2310-8819/JCTH-2023-00095
团队简介
通讯作者
王建设
教授,博士生导师,国家儿童医学中心复旦大学附属儿科医院感染传染肝病科主任。在国际上率先鉴定了MYO5B、USP53、ZFYVE19等新的肝脏疾病,并报道多种遗传性肝病的新表型。国家重点研发计划“生育健康及妇女儿童健康保障”重点专项项目“致命出生缺陷的基因治疗产品研发和临床研究”项目首席科学家,主持国家自然科学基金项目8项。
Victor Ling
加拿大皇家科学院院士,Terry Fox Research Institute首席科学家,BC Cancer Agency创始院长,长期致力于ABC转运蛋白的研究。
第一作者
刘腾
博士,国家儿童医学中心复旦大学附属儿科医院感染传染肝病科主治医师,助理研究员,讲师,上海市闵行区春申人才。2016-2018年获得国家留学基金委奖学金支持,加拿大不列颠哥伦比亚大学联合培养博士。主要从事遗传性肝病代谢组学研究,已发表相关论文十余篇。先后获得复旦大学产学研高新技术转化孵化项目、上海市扬帆计划、国家自然科学基金、上海市卫生健康委卫生行业临床研究专项的支持。
期刊简介
Journal of Clinical and Translational Hepatology(JCTH,《临床与转化肝脏病杂志》,pISSN: 2225-0719, eISSN: 2310-8819)是由重庆医科大学附属第二医院主办,Xia & He Publishing Inc. (华誉出版社)出版的英文学术期刊,主要收录肝病领域的临床或转化相关的研究论文、综述、述评等。
2022 Impact Factor: 3.6
2022 CiteScore: 5.6
投稿:
https://mc03.manuscriptcentral.com/jcth
邮箱:
jcth@xiahepublishing.com 陈老师
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。