国际肝病 发表时间:2025/10/29 22:55:20
编者按:代谢相关脂肪性肝病(MAFLD)是全球高发的慢性肝病,而代谢相关脂肪性肝炎(MASH)作为MAFLD的严重类型,以肝细胞损伤、小叶炎症及肝纤维化为核心特征[1, 2],不仅显著增加肝硬化、肝癌风险,且全球患病率持续上升[3],而现有治疗手段有限,难以满足临床需求。在这一背景下,MASH的全球药物研发管线日趋丰富,涌现出包括基于胰高血糖素样肽-1(GLP-1)的单/多靶点药物、甲状腺激素受体β(THR-β)在内的多类在研新药。其中,胰高血糖素受体(GCGR)/GLP-1受体(GLP-1R)双靶点药物因兼具代谢与肝脏调节而受到广泛关注。
在近期召开的中华医学会第二十五次消化系病学术会议(CGC 2025)上,GCGR/GLP-1R双激动剂Survodutide公布了一系列研究成果,展现出MASH治疗的潜力。为及时传递前沿动态、助力临床实践与科研探索,本刊特对Survodutide的相关研究进展予以整理。作为MASH治疗领域的潜力创新药物,Survodutide不断积累的积极新证,为未来突破MASH治疗瓶颈、改善患者长期预后带来新的可能。
机制解码
Survodutide如何直击MASH核心
Survodutide作为创新GCGR/GLP-1R双激动剂,通过协同激活两种受体,在机制上区别于单一GLP-1R激动剂[4, 5]。具体表现为,GLP-1R可促进葡萄糖依赖性胰岛素分泌、延缓胃排空、抑制食欲,通过改善糖代谢与减少食物摄入间接改善肝脏代谢;GCGR可直接促进肝细胞内脂肪酸氧化、减少肝脏脂肪合成、促进肝脏脂肪分解;间接促进脂肪组织的脂肪分解;直接促进糖原分解、糖异生(图1)。 GCGR/GLP-1R双激动剂可直接靶向肝脏,通过GLP-1R激动作用(减少能量摄入)与GCGR激动作用(增加能量消耗)相结合,为改善肥胖和MASH患者的代谢健康提供了一种新的治疗策略。
图1. GCGR/GLP-1R的双重激动作用
Survodutide是由内源性激素胰高血糖素(GCG)与GLP-1优化得到的29个氨基酸肽段,通过两项结构优化设计延长半衰期并确保药效[6]:一是引入可抵抗二肽基肽酶-4(DPP-4)水解的合成氨基酸,同时添加增强溶解度与稳定性的氨基酸;二是通过含C18二酸的甘氨酸-丝氨酸连接子介导白蛋白结合,显著降低肾脏清除率。
研究数据新探
Survodutide在MASH治疗中的潜力
本次会上,Survodutide有多项针对性研究同步释放亮眼成果。这些研究具体涵盖减重之外的肝脏直接效应解析、无创生物标志物的持续改善追踪以及体外肝球体模型的机制验证,多维度最新证据进一步揭示其治疗潜力。
1
减重之外的直接肝脏影响
一项多中心、随机、双盲、剂量探索Ⅱ期临床试验,探讨了Survodutide在MASH伴肝纤维化(F1-F3期)患者中的有效性和安全性。针对其中170例F2/F3期肝纤维化患者的中介分析显示,Survodutide对肝脏终点的治疗效应分为体重依赖与非依赖两部分[7]。对于PRO-C3、ELF评分、AST、ALT等炎症和纤维化相关指标,Survodutide不依赖于体重减轻,主要通过GCG效应实现对肝脏直接获益;而MASH消退/缓解、磁共振质子密度脂肪分数(MRI-PDFF)、受控衰减参数(CAP)等指标的改善则部分依赖体重减轻(图2)。这一结果提示,Survodutide可通过GCGR直接作用于肝脏,而非仅通过减重间接改善。
图2. 由体重减轻介导的各项指标百分比
2
无创生物标志物的持续改善
Ⅱ期试验的一项纵向分析显示,Survodutide治疗48周可持续改善多类无创生物标志物[8]。肝纤维化相关标志物中,ELF评分较基线水平的绝对降幅(0.57-0.61)显著高于安慰剂组(0.05,均P<0.0001;图3),其组分透明质酸、Ⅲ型前胶原前肽(PⅢNP)、金属基质蛋白酶组织抑制因子1(TIMP-1)均显著降低(P<0.01;表1)。
图3. ELF评分自基线起随时间的估计绝对变化
表1. 第4、28和48周时,透明质酸、PⅢNP和TIMP-1水平的估计几何均数
Survodutide组的PRO-C3相对降幅为0.71-0.74(安慰剂组1.01,P<0.0001),FIB-4指数相对降幅为0.80-0.85(安慰剂组1.04,P<0.001),AST与血小板比率指数(APRI)相对降幅为0.49-0.53(安慰剂组0.94,P<0.0001)。肝细胞存活相关的CK18-M30、CK18-M65相对降幅分别为0.25-0.34、0.3-0.4(安慰剂组分别为0.78、0.9,P<0.0001),提示肝细胞损伤减少。
3
无创检测对肝活检结局的预测价值
一项纳入95例Survodutide治疗的F2/F3期患者的探索性分析显示,部分非侵入性检测(NIT)变化可有效预测肝活检结局[9]。对于“MASH消退且纤维化无恶化”,MRI-PDFF相对变化、ELF评分绝对变化、FAST评分相对变化为主要预测因子(表2),全数据集AUC为0.854(95%CI:0.777-0.932,P<0.0001;图4)。
表2. NIT对预测“MASH消退且纤维化未恶化”结局的相对重要性
图4. 预测MASH消退且纤维化未恶化的ROC曲线
对于“纤维化改善且MASH无恶化”,ELF评分绝对变化、ALT相对变化、PRO-C3相对变化、MRI-PDFF相对变化、FAST评分相对变化为关键预测因子(表3),全数据集AUC为0.811(95%CI:0.727-0.895,P<0.0001;图5)。这表明,NIT应在临床试验及临床实践中发挥重要的作用。
表3. NIT对预测“纤维化改善且MASH未恶化”结局的相对重要性
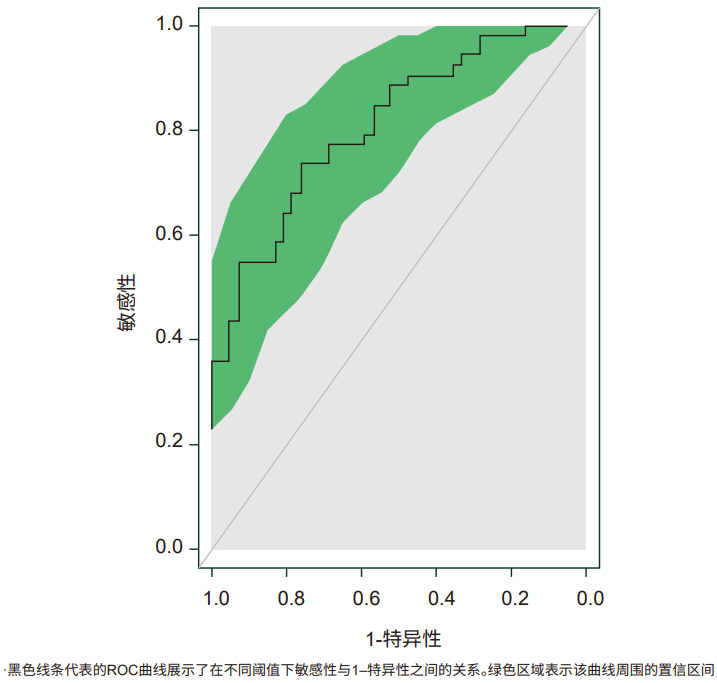
图5. 预测纤维化改善且MASH未恶化的ROC曲线
4
获益机制探究
在模拟健康人和MASH患者肝脏表型的肝球体模型中,观察到Survodutide可升高环磷酸腺苷(cAMP)水平,而司美格鲁肽、替尔泊肽未升高cAMP[10]。同时,Survodutide在MAFLD肝球体中升高cAMP水平的绝对增加幅度是瘦体重对照组的3倍[10]。提示其通过GCGR-cAMP通路发挥肝脏保护作用。
此外,Survodutide展现出抗脂肪变性与抗纤维化作用[10]。与对照肝球体相比,MASH肝球体甘油三酯含量显著增加9.8倍,PC-1分泌量显著增加10.3倍(P<0.0001);Survodutide 0.3μmol/L可使细胞内甘油三酯含量显著降低23.8%(P<0.05),1μmol/L可使PC-1分泌量降低35.0%。
图6. Survodutide对肝球体的浓度-效应关系:a)PC-1分泌量;b)甘油三酯含量[均值±标准误];c)为多种候选药物(圆点)与Survodutide(方形)PC-1分泌量相较甘油三酯水平百分比的散点图(以MASH溶剂对照进行标准化);LDH值以氯丙嗪依赖性LDH释放百分比的颜色密度热图呈现
写在最后
Survodutide的多项最新研究进展在MASH伴肝纤维化治疗领域展现出多重临床价值。研究显示,Survodutide具有独立于体重的直接肝脏效应,其或可对于非肥胖MASH患者也具潜力。Survodutide可持续改善多项无创生物标志物,无创检测指标的变化可有效预测肝活检结局。体外研究也进一步探究了GCGR-cAMP通路的肝脏获益机制,为药物的临床获益提供了理论支持。
参考文献:
[1] Rinella ME, Lazarus JV, Ratziu V, et al. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. Hepatology. 2023;78(6):1966-1986. doi:10.1097/HEP.0000000000000520
[2] European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD). J Hepatol. 2024;81(3):492-542. doi:10.1016/j.jhep.2024.04.031
[3] Dong X, Li JM, Lu XL, et al. Global burden of adult non-alcoholic fatty liver disease (NAFLD) and non-alcoholic steatohepatitis (NASH) has been steadily increasing over the past decades and is expected to persist in the future. Transl Gastroenterol Hepatol. 2024;9:33. Published 2024 Jun 24. doi:10.21037/tgh-23-118
[4] Del Prato S, Gallwitz B, Holst JJ, Meier JJ. The incretin/glucagon system as a target for pharmacotherapy of obesity. Obes Rev. 2022;23(2):e13372. doi:10.1111/obr.13372
[5] Sánchez-Garrido MA, Brandt SJ, Clemmensen C, Müller TD, DiMarchi RD, Tschöp MH. GLP-1/glucagon receptor co-agonism for treatment of obesity. Diabetologia. 2017;60(10):1851-1861. doi:10.1007/s00125-017-4354-8
[6] Zimmermann T, Thomas L, Baader-Pagler T, et al. BI 456906: Discovery and preclinical pharmacology of a novel GCGR/GLP-1R dual agonist with robust anti-obesity efficacy. Mol Metab. 2022;66:101633. doi:10.1016/j.molmet.2022.101633
[7] Noureddin M, et al. 胰高血糖素受体/胰高血糖素样肽-1受体双激动剂Survodutide在减重之外对肝脏终点的直接影响:来自II期试验的启示. 中华医学会第二十五次消化系病学术会议(CGC2025).
[8] Noureddin M, et al. 新型胰高血糖素受体/胰高血糖素样肽-1受体双激动剂Survodutide对无创生物标志物的持续改善:一项针对代谢相关脂肪性肝炎合并纤维化患者II期试验的纵向分析. 中华医学会第二十五次消化系病学术会议(CGC2025).
[9] Noureddin M, et al. 用于预测Survodutide治疗后肝活检结果的非侵入性检测:II期试验探索性分析[EB/OL]. 中华医学会第二十五次消化系病学术会议(CGC2025).
[10] Vonschallen P, et al. Survodutide在人肝细胞球模型中通过胰高血糖素组分激活cAMP信号通路并减少脂肪变性和纤维化. 中华医学会第二十五次消化系病学术会议(CGC 2025).
SC-CN-18167,有效期至2026.10.28
(来源:《国际肝病》编辑部)
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。