AJPS丨李兰娟院士/曹红翠教授团队:间充质干细胞来源外泌体可改善原发性硬化性胆管炎肝纤维化
—— 作者: 时间:2024-03-08
阅读数:
6
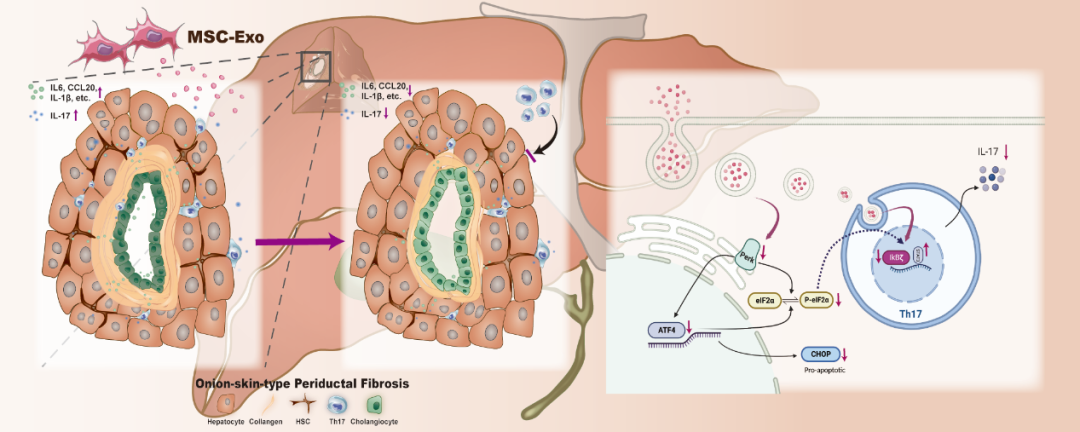
近期,浙江大学医学院附属第一医院传染病重症诊治全国重点实验室李兰娟院士/曹红翠教授团队在Asian Journal of Pharmaceutical Sciences (JCR:Q1, IF:10.2)上发表了题为“MSC-derived exosomes attenuate hepatic fibrosis in primary sclerosing cholangitis through inhibition of Th17 differentiation”的原创性研究论文。该研究发现胎盘间充质干细胞来源外泌体可通过抑制Th17分化改善PSC肝脏纤维化,调控PERK/CHOP通路缓解Th17诱导的肝纤维化微环境,改善胆管细胞高分泌表型以及肝星状细胞与胆管细胞之间的相互作用,为PSC发病机制研究及治疗手段探讨提供了新型思路。曹红翠教授为通讯作者,课题组在读博士生陈文怡为第一作者,李兰娟院士为本研究提供了技术指导。

文章发表封图
doi: 10.1016/j.ajps.2024.100889
研究背景
原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)是一种以慢性进行性胆管炎与肝纤维化为特征的胆汁淤积性疾病,主要表现为肝内外胆管炎症性破坏,导致胆汁淤积和肝纤维化,最终进展为肝硬化。目前尚无根治性药物,肝移植是终末期PSC唯一有效疗法。PSC的发病机制虽然尚未明确,近期多项研究发现PSC患者胆管免疫细胞可通过影响肝脏微环境,驱动肝脏炎症和纤维化。间充质干细胞(mesenchymal stem cell, MSC)具有低免疫原性和多向分化潜能的优势,在多种疾病中可发挥免疫调控、改善炎症、组织修复和抗纤维化作用。李兰娟院士/曹红翠教授课题组已发表成果及其它既往研究表明,MSC来源外泌体在急/慢性肝衰竭、肝纤维化和炎症性肠病等中可发挥免疫调控作用,改善炎症并促进组织修复再生。针对胎盘间充质干细胞来源外泌体(ExoMSC)是否可改善PSC肝纤维化,课题组结合PSC模型鼠(Mdr2-/-鼠)和PSC患者肝组织来源多细胞类器官,对ExoMSC治疗PSC肝纤维化的疗效及机制展开探索。
研究发现
01
MSC来源外泌体可改善PSC小鼠肝纤维化
Mdr2-/-小鼠经ExoMSC注射四周后(图1A),与对照鼠(Mdr2+/+)相比小鼠血清肝功能指标ALT、AST和ALP水平在前三周反应性升高,在第四次注射后得到明显改善(图1B)。肝组织切片经免疫荧光(α-SMA)、天狼星红染色及免疫组化染色(Desmin,GFAP)后,发现肝内汇管区周围胶原沉积得到明显改善,纤维化相关蛋白α-SMA及肝星状细胞(HSC)活化相关标志物Desmin和GFAP表达显著降低(图1C-J)。Mdr2-/-鼠肝组织表达纤维化相关基因Tnf-α、Acta2、Tgf-β2、Tgf-β1、Col3a1和Col1a1水平受ExoMSC作用表达降低(图1K)。以上结果提示ExoMSC多次治疗可显著改善PSC模型鼠肝脏功能及肝纤维化。
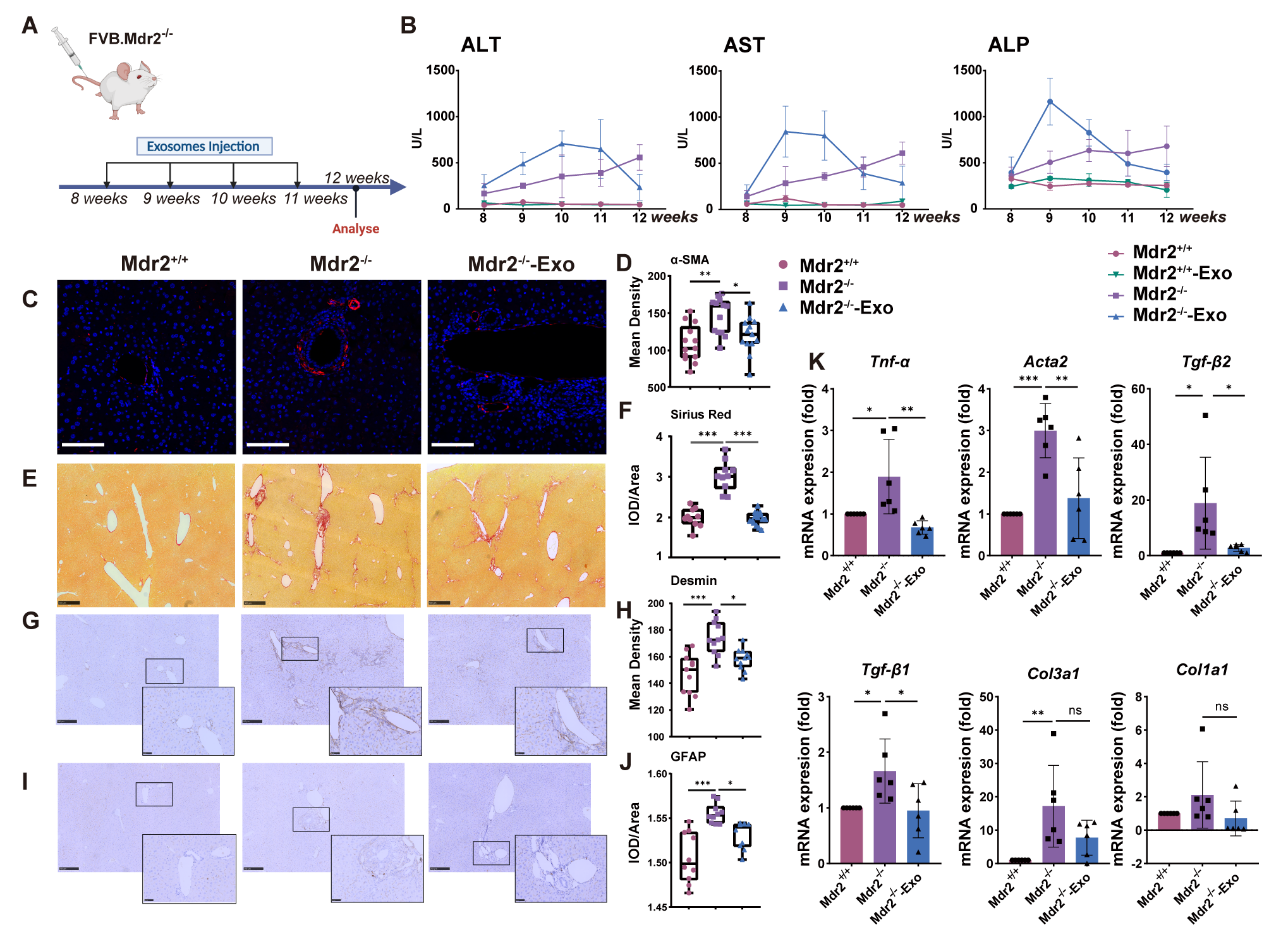
图1. ExoMSC治疗后Mdr2-/-小鼠肝脏纤维化得到显著改善
(图片源自:AJOPS 2024)
02
动物和细胞模型显示ExoMSC可抑制Th17分化
为了进一步探索ExoMSC发挥疗效的机制,本研究将三组小鼠(Mdr2+/+、Mdr2-/-和Mdr2-/--Exo)肝组织行转录组学(RNA-seq)GSEA分析,发现ExoMSC治疗后Th17分化通路受到显著抑制(图2A-B)。此外,Mdr2-/--Exo组小鼠肝组织汇管区IL-17A染色阳性细胞相对减少(图2C);治疗组肝内免疫细胞CD4+IL17A+T细胞占比降低明显(图2D-F)。体外分离外周血Na?ve CD4+T细胞,于分化过程中添加不同浓度的ExoMSC发现Th17细胞占比显著降低(图2E-G),Th17分泌IL-17A功能受外泌体作用显著下调(图2H-I)。
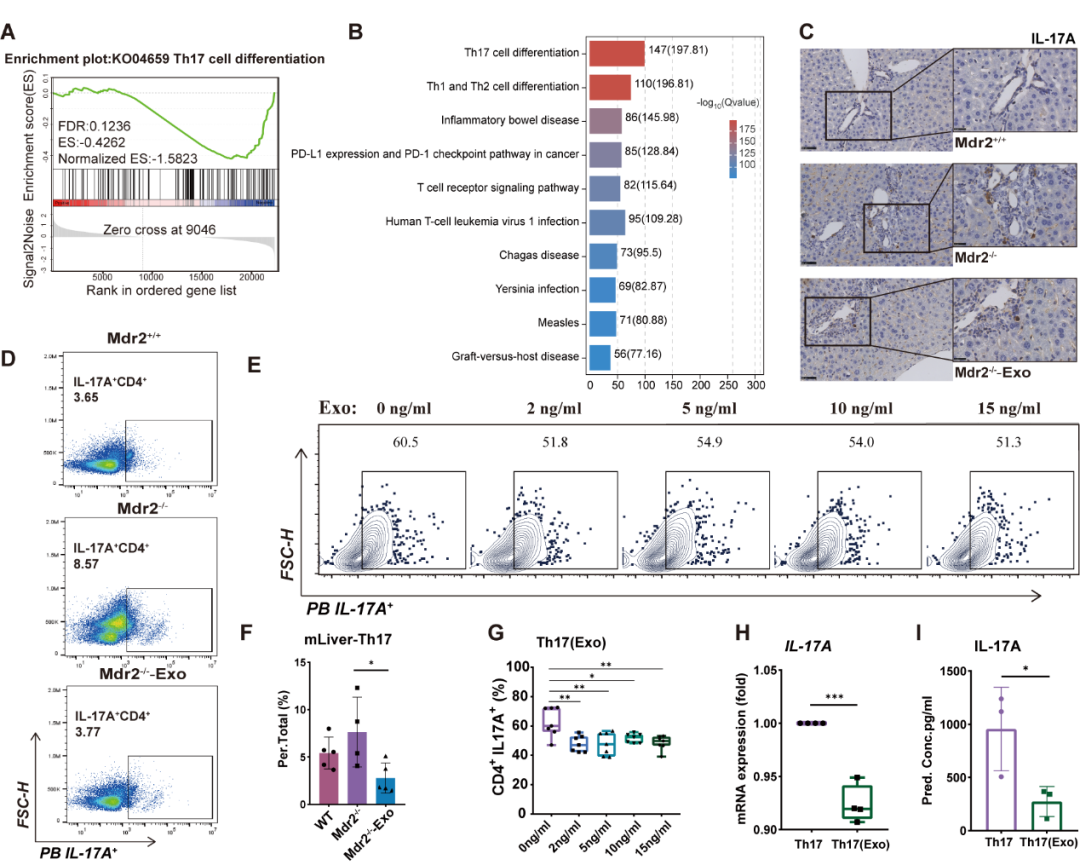
图2 .ExoMSC可于Mdr2-/-鼠体内及体外培养的CD4+T细胞中抑制Th17分化
(图片源自:AJOPS 2024)
03
ExoMSC可改善Th17诱导的肝纤维化微环境
为了探究Th17在PSC肝纤维化中发挥的作用,以及ExoMSC调控Th17分化缓解肝纤维化的具体机制,本研究构建了人组织来源类器官来模拟肝内环境(图3A)。PSC患者肝内胆管细胞经3D培养后可形成具有膜转运功能及表达细胞周期相关蛋白的类器官(图3B)。本研究发现,Th17分泌的IL-17A可促进胆管类器官分泌IL-4、IL-6、IL-1β和CCL20等炎症趋化因子(图3C);上调HSC表达纤维化相关基因COL1A1和COL3A1(图3D),且其培养上清对Th17有显著趋化作用图3E)。而当胆管类器官与HSC进行Trans-well共培养时(图3F),炎症趋化因子水平、纤维化相关基因在IL-17A诱导后分泌相比单独培养时上调更加明显,且上述表型都可在ExoMSC作用下得到改善(图G-I)。这表明ExoMSC对IL-17A诱导的肝纤维化相关微环境具有显著的改善作用。

图3. ExoMSC通过调节胆管-HSC间微环境改善Th17诱导的肝纤维化
(图片源自:AJOPS 2024)
04
ExoMSC发挥疗效的机制通路研究
为了进一步探讨ExoMSC发挥疗效的具体机制通路,本研究将小鼠肝组织转录组学KEGG数据分析结果(图4A-C),行肝组织蛋白WB验证信号通路水平(图4D),发现PERK/p-Eif2α/CHOP在肝组织内受ExoMSC作用显著下调,而且发现了转录因子IKBζ在Th17分化受抑制过程中发挥重要作用(图4E)。为了进一步验证所发现的机制通路是否在Th17诱导的肝内微环境中发挥作用,本研究构建了多细胞类器官培养系统(图4F-G),发现IL17A可诱导HSC-胆管类器官(HSC-Orgs)和肝细胞-胆管类器官(Hep-Orgs)上调信号分子PERK/CHOP的表达,在ExoMSC处理后其水平受到显著下调(图4H)。这显示了IKBζ水平和PERK/CHOP通路在ExoMSC改善PSC肝脏纤维化过程中发挥的重要作用。

图4. ExoMSC通过下调IKBζ及调控PERK/CHOP通路发挥疗效
(图片源自:AJOPS 2024)
研究者说
肝脏纤维化为PSC疾病进展周期最长的病程,聚焦PSC免疫紊乱以及特征性纤维化病程,可为PSC患者争取更长的生命周期与更高的生活质量。本研究揭示了间充质干细胞来源外泌体改善PSC肝纤维化及汇管区免疫相关微环境的调控机制,探讨了多细胞类器官作为疾病体外模型及疗效与机制探索的巨大潜力,为PSC或Th17相关疾病的研究与治疗提供了理论及数据支持。
(来源:《国际肝病》编辑部)

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
研究
专家访谈
肝纤维化
发表评论
全部评论
