当前位置:AASLD-美国肝病研究学会年会 » 正文
AASLD盘点丨代谢相关脂肪性肝病新疗法:恩格列净、Saroglitazaar、Retatrutide等
—— 作者: 时间:2023-11-13 02:54:18 阅读数:
12

编者按
代谢相关脂肪性肝病(MAFLD)已成为全球慢性肝病最主要的病因,然而目前尚没有针对性的有效治疗药物,近年来围绕MAFLD和代谢相关脂肪性肝炎(MASH)的新药研发喜忧参半。2023年美国肝病研究学会年会(AASLD2023)在众多摘要投稿中遴选出6项MAFLD新疗法研究,《国际肝病》特此编译,让我们一起看看进展如何。“Novel Therapeutic Approaches for MASH”专题将展示相关内容,感兴趣的读者可于当地时间11月13日上午08:30上线听听。
01
使用基因组优先方法对TM6SF2进行深度表型分析,以表征肝脏脂肪变性、血脂特征和代谢危险因素
研究背景
一种无偏见的“基因组优先”方法,可能扩大对与非酒精性脂肪性肝病(NAFLD)相关的常见编码和预测功能丧失(pLOF)变异的理解。利用这种方法美国宾夕法尼亚大学Huang H等旨在揭示TM6SF2致病变异体的功能。
研究方法
利用美国宾夕法尼亚大学医学院生物库(Penn Medicine Biobank,PMBB)中44297例患者的外显子组测序数据,调查分析了121个非同义错义变异体和12个pLOF变异体与ICD-10编码NAFLD、非酒精性脂肪性肝炎(NASH)和肝细胞癌(HCC)的相关性。在对年龄、性别、体重指数(BMI)、祖先主成分和PNPLA3 rs738409:G携带情况进行调整后,进一步分析血清参数、肝脏脂肪分数和影像学结果,以考察显著变异。在英国生物样本库(UK Biobank, UKB)中复制了研究结果,当P<0.05时,差异具有统计学显著性。使用ColabFold Alphfold2笔记本与MMseqs2进行TM6SF2结构的计算机预测。
研究结果
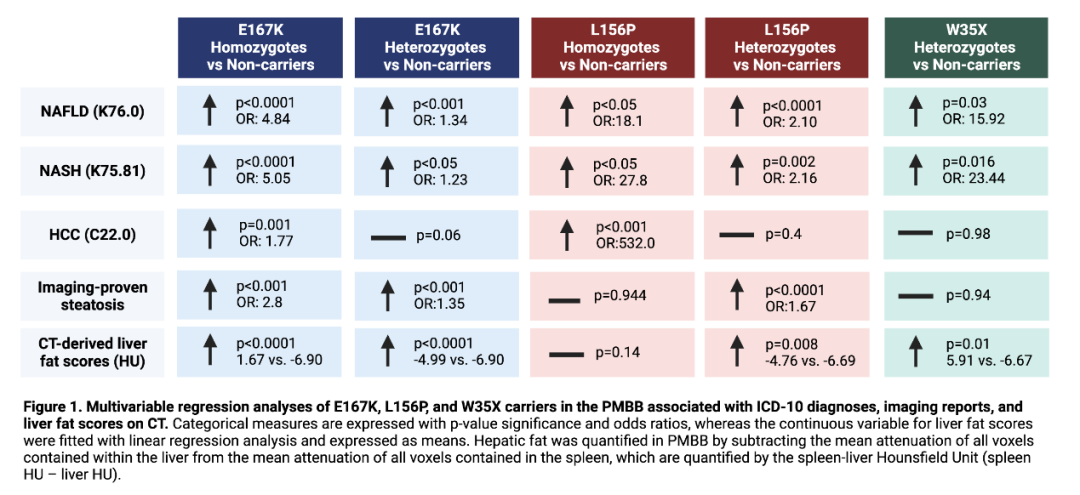
E167K纯合子增加了患ICD诊断的NAFLD(P<0.0001,OR:4.8)、NASH(P<0.0001,OR:5.1)和HCC(P=0.001,OR:1.77)的风险。E167K杂合子也表现出类似的趋势,仅限于NAFLD和NASH。此外,L156P杂合子增加了患医师诊断的NAFLD(P<0.001,OR:2.16)和NASH(P<0.0001,OR:2.10)的风险。只有L156P纯合子增加患HCC的风险(N=2,P<0.0001,OR:532.0)。我们在UKB中成功复制了这2个变异与ICD诊断的NAFLD、NASH和HCC的关联。在PMBB人群中,额外的影像学诊断,联合CT衍生的肝脏脂肪分数升高的证据,强化了E167K和L156P携带者中的这些关联(P<0.01)。
代谢组学分析显示,E167K和L156P携带者的循环总胆固醇、甘油三酯、脂肪酸和总胆碱较低(经Bonferroni校正,P<0.0001)。计算机预测证实,这两种突变都会导致EXPERA结构域的结构破坏,导致TM6SF2蛋白功能丧失。当我们调查分析pLOF变异并发现一个与医师诊断的NAFLD(P =0.03,OR:15.9)、NASH(P=0.01,OR:23.4)和肝脂肪分数升高(P<0.001)的风险增加的截短终止密码子(W35X)时,这一假设得到了加强,其方向与E167K和L156P相同。
研究结论
该研究确认了E167K和L156P对蛋白质结构产生功能丧失的影响,从而导致肝病,并确定了一个具有潜在治疗NAFLD效用的终止密码子。
02
三重激素受体激动剂Retatrutide可解决85%以上MASLD和肥胖受试者的脂肪变性,并改善代谢健康
研究背景
三重激素受体激动retatrutide(RETA;LY3437943)是胰高血糖素样肽-1受体(GLP-1)、葡萄糖依赖性促胰岛素释放多肽受体(GIP)和胰高血糖素受体(GCG)的联合激动剂,正在研究用于肥胖治疗。一项为期48周的2期肥胖研究表明,服用RETA 8mg和12 mg可分别减轻22.8%和24.2%的体重。美国弗吉尼亚联邦大学Sanyal AJ在会上报告了RETA对代谢相关性脂肪性肝病(MASLD)受试者肝脏脂肪的影响以及与代谢指标的相关性。
研究方法
体重指数(BMI)≥30,或BMI≥27 kg/m2且合并≥1种体重相关疾病的18~75岁成人受试者(不包括2型糖尿病患者)被随机分配到RETA(1、4、8或12 mg)组或安慰剂组,治疗方案为每周一次皮下注射,共治疗48周。MASLD亚组研究纳入MRI质子密度脂肪分数(PDFF)评估的肝脏脂肪含量≥10%的受试者。主要结果是24周时肝脏脂肪含量相比基线的变化(LF CFB)。其他结果包括48周时LF CFB和肝脏脂肪含量<5%的受试者比例。此外,还研究了LF CFB与体重、腰围和空腹代谢生物标志物变化之间的关系。
研究结果
在338例受试者中,98例(46.9%为女性)参加了亚组研究,平均年龄为46.6岁,平均BMI为38.4 kg/m2,平均腰围为118.3 cm,平均谷丙转氨酶(ALT)为35.9 IU/L,平均谷草转氨酶(AST)为25.4 IU/L,纤维蛋白4(FIB4)为0.79,增强肝纤维化评分(ELF)为8.1分。
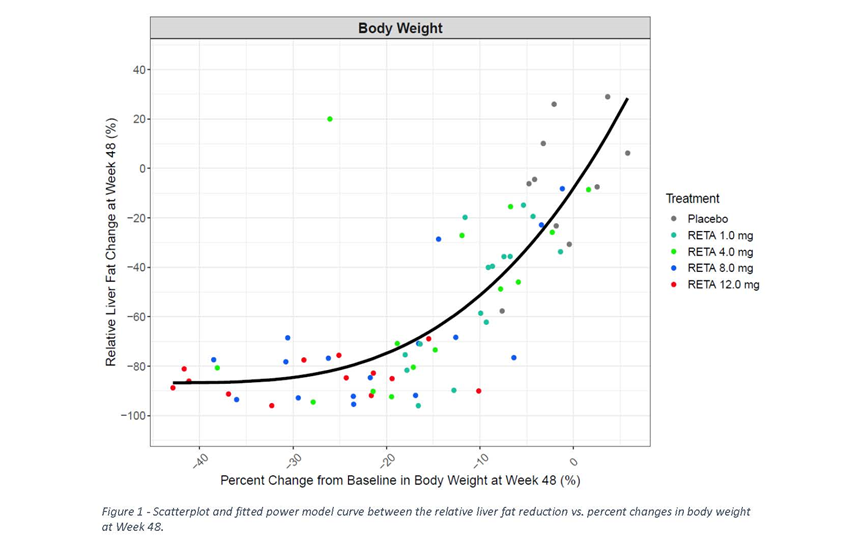
各治疗组的平均基线肝脏脂肪含量范围在15.6%至21.0%。24周的平均相对LF CFB(%)分别为-42.9 %(RETA 1mg)、-57.0%(4mg)、-81.4 %(8mg)、-82.4%(12mg)和+0.3%(安慰剂),48周的平均相对LF CFB分别为-51.3 %(1mg)、-59.0 %(4mg)、-81.7 %(8mg)、-86.0%(12mg)和-4.6 %(安慰剂)(与安慰剂相比,P均< 0.001)。
在第48周,各组实现肝脏脂肪含量<5%的受试者比例分别为57%(1 mg)、29%(4 mg)、89% (8 mg)、93%(12 mg)和0%(安慰剂);与安慰剂相比,P均< 0.001。ALT和AST与安慰剂相比,变化不一致。在第48周,相对LF CFB 降低与体重和腰围相对基线的改变显著相关(r分别=0.774和0.588;均P< 0.001);证明了LF CFB 与体重自基线改变的非线性关系,在体重降低约20%时,肝脏脂肪降低接近最大值(P=0.002)。RETA剂量≥4 mg,改善了胰岛素敏感性,反映在24和48周时空腹胰岛素(范围:-37.3至-70.9%)和HOMA2-IR(胰岛素;-35.8%至-69.3%)相比安慰剂组降低,脂联素则比安慰剂组增加(29.8%至99.3%)(P均<0.05)。
到第24周,与安慰剂相比,RETA剂量≥4 mg显著改变了脂质储存和代谢的生物标志物(P<0.05),包括甘油三酯(TG;范围-35.4至-40.0%)、瘦素(-29.0至-55.8%)和FGF-21 (-52.2至-65.7%)降低,以及脂肪酸氧化标志物β-羟基丁酸(BOHB;78.0至181.2%)增加。在第24和48周,观察到相对肝脏脂肪含量降低,与肝体积、TG、胰岛素、HOMA2-IR、脂联素、瘦素和FGF-21相对基线的改变呈显著的(P<0.05)线性相关,但与BOHB无关。
研究结论
RETA 8和12 mg治疗,解决了85%以上MASLD受试者的脂肪变性。在体重减少约20%时,肝脏脂肪含量降低达到最大程度。肝脏脂肪含量降低与胰岛素敏感性和脂质代谢改善相关的代谢指标呈线性相关。
03
非酒精性脂肪性肝炎和纤维化患者非侵入性测量与组织学反应的关系:来自Ⅲ期MAESTRO-NASH试验的52周数据
研究背景
MAESTRO-NASH(NCT03900429)是一项正在进行的为期54个月、随机、双盲、安慰剂对照的Ⅲ期试验,旨在评估Resmetirom对活检证实的非酒精性脂肪性肝炎(NASH)伴纤维化患者的疗效。966例经活检证实的NASH患者被随机1:1:1地分入80 mg Resmetirom组、100 mg Resmetirom组或安慰剂组接受每日一次治疗。52周后评估组织学终点。80 mg和100 mg的Resmetirom在第52周时均达到双重主要终点:NASH消退,无纤维化恶化(无反应,NR)或纤维化减少1分,无NAS(NAFLD活动评分)恶化(部分反应,FR)。
研究方法
具有≥3个代谢危险因素、肝硬度≥8.5 kPa、肝脏脂肪含量≥8%、活检证实NASH伴F1B-F3纤维化、NAS评分≥4的成人有资格参加MAESTRO-NASH试验。评估了Resmetirom 80mg、Resmetirom 100mg和安慰剂组的非侵入性测量与组织学反应(NR和/或FR)的关系。
研究结果
经活检证实的NASH伴纤维化患者具有高代谢风险,包括肥胖(平均BMI 36)、2型糖尿病(70%)、高血压(78%)和10年动脉粥样硬化性心血管疾病(ASCVD)风险评分>14。Resmetirom 80mg组、Resmetirom 100mg组和安慰剂组的FibroScan VCTE基线均值(SD)分别为13.3(6.8)、13.6(7.1)和12.9(5.6)kPa。所有纤维化组的基线增强肝纤维化评分(ELF)为9.8分(0.87)。所有剂量组的FIB-4为1.3。
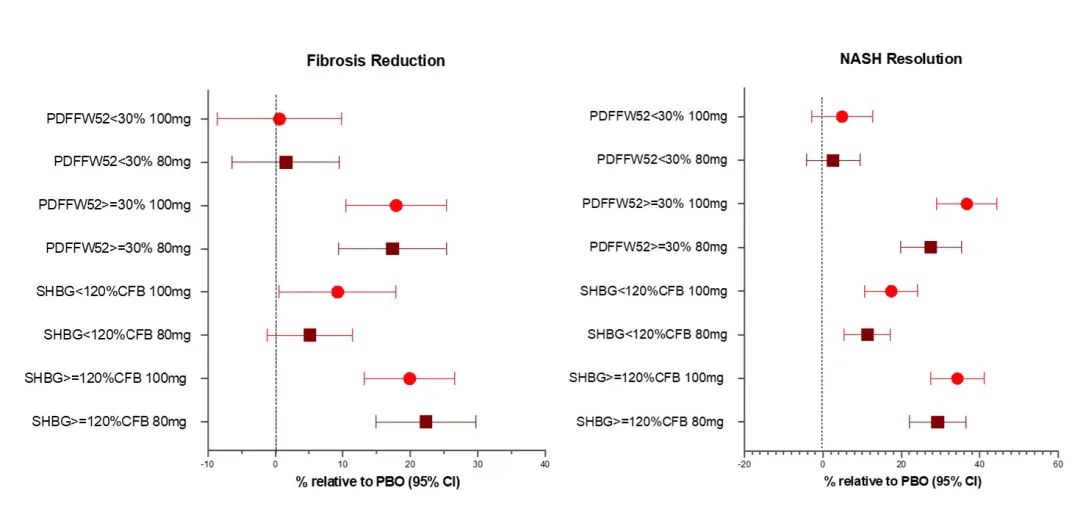
在80 mg和100 mg剂量的配对活检人群中,MRI-PDFF评分分别平均降低了42%和52%。在80 mg或100 mg Resmetirom治疗组且MRI-PDFF评分比基线降低≥30%的受试者中,实现NR(即纤维化不恶化)的比例分别比安慰剂组多28%和38%,实现FR(即NAS评分不恶化)的比例分别比安慰剂组多17%和18%。在SHBG(药物暴露标志物)增加≥120%的Resmetirom治疗患者中,80mg和100mg组实现NR的患者比例分别比安慰剂组多34%和37 %, 实现FR的患者比例分别比安慰剂组多22%和20%。
在100 mg Resmetirom组NR、FR和NR和/或FR反应者中,分别有96%、88%和92%的受试者MRI-PDFF(组织学反应阈值)降低≥30%。无NR或FR且MRI-PDFF降低≥30%的Resmetirom组患者中,有一半显示NAS评分降低≥2分。在活检中,NR与FR相关(r2=0.30)。100mg Resmetirom组NR和FR的其他相关因素包括PDFF(r2=0.39,0.23)、ALT(r2=0.20,0.24)降低以及肝脏体积(r2=0.25,0.18)减小。AST和FibroScan CAP的相关性较弱。80mg的相关系数相似。LDL-C降低与NR或FR都不相关。虽然Resmetirom治疗降低了MRE(kPa)、Fibroscan VCTE和ELF,但这些非侵入性测量的降低与NR或FR无关。
研究结论
在两种剂量(80和100 mg)Resmetirom治疗下,NASH消退和纤维化减少与MRI-PDFF较基线减少≥30%和SHBG增加≥120%相关。其他分析,包括基于人工智能的组织学反应评估,正在进行中。
04
Itfg1:增强肝再生能力和慢性肝病治疗的有希望的靶点
研究背景
肝脏具有显著的再生能力,然而在慢性肝损伤条件下,这种能力会耗尽,从而导致纤维化组织的蓄积,并导致终末期肝病。通过靶向再生中断来增强内源性再生能力,是一种新的治疗方法。研究者建立了一个体内功能基因筛选机制,来识别这种再生中断。整合素-β样1基因(Itfg1)是研究热门靶点之一,已证实肝细胞特异性敲低Itfg1可增强肝脏的内源性再生能力,并能够对抗慢性肝病。
研究方法
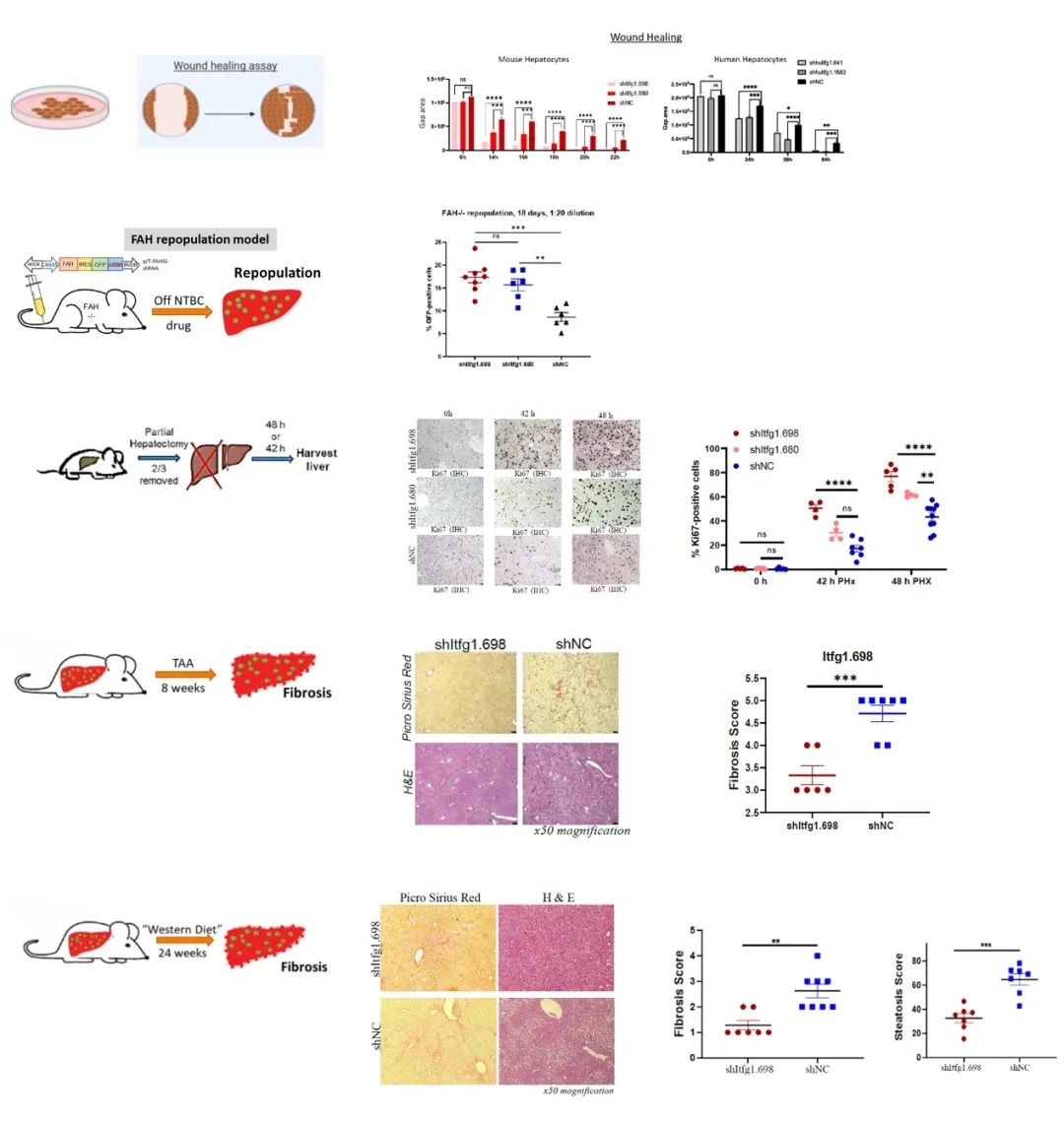
研究者在硫代乙酰胺(TAA)驱动的慢性肝病模型中,进行了体内功能性基因RNA干扰(RNAi)筛选。2个独立的靶向Itfg1的短发夹RNA(shRNAs)被显著富集。随后在体外测试了Itfg1敲低对小鼠和人类肝细胞增殖的影响。此外,利用FAH敲除小鼠模型,我们测试了Itfg1敲低驱动的更快的肝脏再生,部分肝切除术后增强的再生和慢性肝损伤条件下的纤维化减少,包括“西方饮食”驱动的非酒精性脂肪性肝病(NAFLD)。为了阐明Itfg1抑制驱动加速肝再生的机制,我们进行了深入的转录组学和蛋白质组学分析。
研究结果
在永生化小鼠和人肝细胞中敲低Itfg1,加速了细胞体外增殖和伤口愈合。肝细胞中Itfg1的体内敲低,加速了其在FAH缺陷小鼠的肝脏中重新繁殖的能力。此外,在完全再生的小鼠中,每个肝细胞表达靶向Itfg1的shRNA,部分肝切除后的肝再生加速。增强的再生能力也减弱了TAA和“西方饮食”引起的慢性损伤。在NAFLD模型中,Itfg1敲低不仅减少了纤维化,还减少了脂肪变性。转录组学和蛋白质组学分析表明,Itfg1敲低影响脂肪酸代谢、MAPK和AKT途径。
研究结论
该研究鉴定并验证了Itfg1作为增强肝脏内源性再生能力的靶点。增强内源性再生能力可减轻慢性肝病。目前正在将研究结果转化为RNAi疗法。
05
随机试验显示,恩格列净在降低T2DM患者和非糖尿病患者的肝脏脂肪含量方面同样有效
研究背景
本研究旨在检测恩格列净(empagliflozin)对T2DM患者和非糖尿病患者肝脏脂肪含量的影响,以及肝脏脂肪减少与恩格列净其他代谢作用之间的关系。
研究方法
30例T2DM患者和27例非糖尿病患者以2:1的比例随机双盲接受恩格列净或匹配安慰剂治疗。患者在治疗前和治疗结束时接受75克口服葡萄糖耐量试验(OGTT)试验与肝脏脂肪含量的核磁共振波谱分析。用3H-葡萄糖输注测量治疗开始时的肝脏葡萄糖产量。
研究结果
在T2DM和非糖尿病受试者中,恩格列净分别导致肝脏脂肪含量绝对减少2.75%和1.93%,安慰剂组的肝脏脂肪含量则分别增加0.9%和0.8%(两组P均<0.05)。肝脏脂肪含量的减少受到基线肝脏脂肪含量的显著影响,并与体重减少(r=0.53,P<0.001)和由恩格列净引起的胰岛素敏感性的改善(r=-0.51,P<0.001)密切相关,但不受空腹血糖减少或肝脏葡萄糖生成增加的影响。
研究结论
恩格列净在降低T2DM患者和非糖尿病患者的肝脏脂肪含量方面同样有效。肝脏脂肪含量的减少与血浆葡萄糖浓度的减少无关,但与体重的减少和胰岛素敏感性的改善密切相关。
06
Saroglitazaar能有效改善非酒精性脂肪性肝炎患者的肝脏硬度和肝酶
研究背景
尽管在理解非酒精性脂肪性肝炎(NASH)的病理生理学方面取得了进展,但还没有药物治疗被证明能有效改善预后。过氧化物酶体增殖物激活受体(PPAR)是在代谢稳态和炎症中起关键作用的核受体,PPAR基因敲除小鼠易患NASH。研究显示PPAR-α在肝脏脂肪变性和炎症中的保护作用,以及PPAR-γ作为胰岛素增敏剂的作用。Saroglitazaar是一种PPAR α和γ双重激动剂,已被批准用于治疗糖尿病血脂异常。尽管该药物在印度已被批准用于NASH患者,但仍需等待有关肝纤维化改善的数据。印度Pandit Bhagwat Dayal Sharma医学科学研究所Gupta T等人在NASH患者中比较了Saroglitazaar单药及其与维生素E联用的疗效。
研究方法
这是一项从2021年7月至2022年12月在一家三级医疗中心进行的前瞻性、随机、开放性临床试验。该研究经机构伦理委员会批准,并在CTRI注册,注册号为CTRI/2021/07/034946。所有活检证实的NASH患者以1:1的分配比例随机接受Saroglitazaar 4 mg OD(I组)或Saroglitazaar 4 mg OD+维生素E 400 IU OD(II组),为期6个月。主要终点是NAS评分、瞬时弹性成像的肝硬度测量(LSM)值和肝酶(SGPT)改善。次要终点是体重指数(BMI)、血清甘油三酯(TG)和胆固醇(Chol)水平的改善。
研究结果
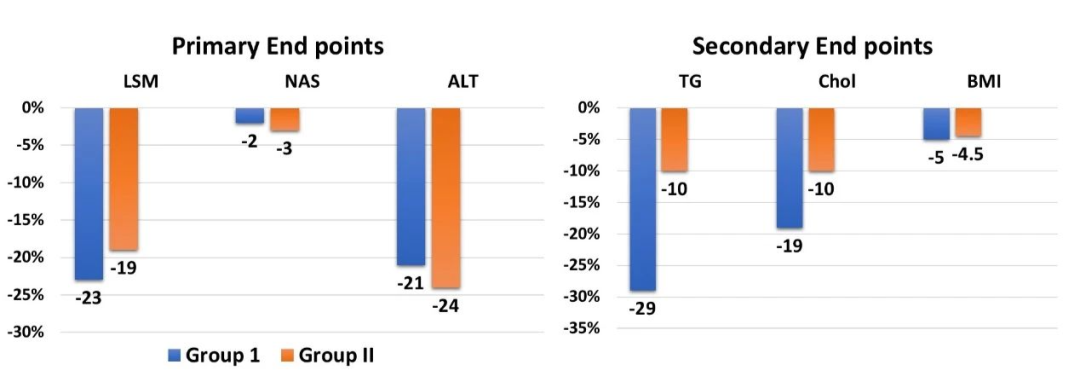
共纳入53例患者,I组有2例患者失访,最后对I组(n=25)和II组(n=26)进行分析。两组间的所有基线特征都具有可比性。在主要终点方面,I组(9.1至7.0 kPa,P=0.03)、II组(7.9至7.1 kPa,P=0.04)的LSM值改善,I组(101至81 U/L,P=0.02)、II组(98至75 U/L,P=0.04)的SGPT值改善显著,两组从基线到24周的NAS评分均无变化。在次要终点方面,I组(234至167 mg/dL,P=0.003;234至199mg/dL,P=0.04)和II组(223至188 mg/dL,P=0.04;229至189 mg/dL,P=0.007)的甘油三酯和总胆固醇显著降低,而BMI则无变化。
研究结论
Saroglitazaar单药治疗能有效改善NASH换着的LSM和SGPT值。然而,在24周的时间内没有观察到NAS评分的改善。
参考文献:
[1] Huang H, Vitali C, Phillips MC, et al. Deep Phenotyping of TM6SF2 to characterize hepatic steatosis, plasma lipid traits, and metabolic risk factors using a genome-first approach. AASLD 2023. Oral 147.
[2] Sanyal AJ, Frias JP, Thomas MK, et al. Triple hormone receptor agonist retatrutide resolves steatosis in >85% of subjects with MASLD and obesity in association with improved metabolic health. AASLD 2023. Oral 148.
[3] Loomba R, Schattenberg JM, Taub RA, et al. Relationship of non-invasive measures with histological response in patients with nonalcoholic steatohepatitis and fibrosis: 52-week data from the phase 3 maestro-NASH trial. AASLD 2023. Oral 149.
[4] Iakovleva V, Potapova A, Ong A, et al. Itfg1: a promising target for enhanced liver regeneration and chronic liver disease treatment. AASLD 2023. Oral 150.
[5] Abdelgani S. Empagliflozin is equally effective in reducing liver fat content in T2DM patients and in non-diabetic individuals, a randomized trial. AASLD 2023. Oral 151.
[6] Gupta T, Kaushik P, Mittal R. Saroglitazaar is effective in improving liver stiffness measurement and liver enzymes in nonalcoholic steatohepatitis. AASLD 2023. Oral 152.


声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
研究
热点聚焦
脂肪肝
发表评论
全部评论