当前位置:AASLD-美国肝病研究学会年会 » 正文
AASLD盘点丨乙型肝炎新疗法: Vebicorvir、 Selgantolimod、Bepirovirsen、治疗性疫苗等
—— 作者: 时间:2023-11-11 10:29:39 阅读数:
26

编者按
目前,已有部分慢性乙型肝炎(CHB)患者可以通过基于干扰素的抗病毒治疗方案实现临床治愈,为追求更多人群的临床治愈,相关新药研发如火如荼。2023年美国肝病研究学会年会(AASLD2023)在众多摘要投稿中最终遴选出6项乙型肝炎新疗法研究,相关内容将于“Hepatitis B: New Therapies for HBV and HDV”专题进行口头展示,《国际肝病》特此编译,感兴趣的读者可于当地时间11月12日上午08:30上线听听。
01
病毒抑制的HBeAg阴性CHB患者应用vebicorvir、核苷(酸)逆转录酶抑制剂和AB-729联合治疗48周后的初步治疗应答:一项开放标签2期研究的分析
在本届AASLD年会上,澳大利亚Gerry MacQuillan等报告了病毒抑制的HBeAg阴性CHB患者应用vebicorvir、核苷(酸)逆转录酶抑制剂和AB-729联合治疗48周的分析结果[1]。
该项开放标签的研究对病毒抑制的HBeAg阴性CHB患者应用vebicorvir(VBR)+AB-729+核苷(酸)逆转录酶抑制剂(NrtI)治疗的安全性和有效性进行评估(NCT04820686)。VBR是第一代核心抑制剂,AB-729是针对所有HBV RNA转录物的单触发GalNAc-siRNA。之前描述了最初的治疗结束时应答。在本届AASLD年会上,研究人员报告了治疗结束时应答的其他数据和初步的停止治疗后应答效果。
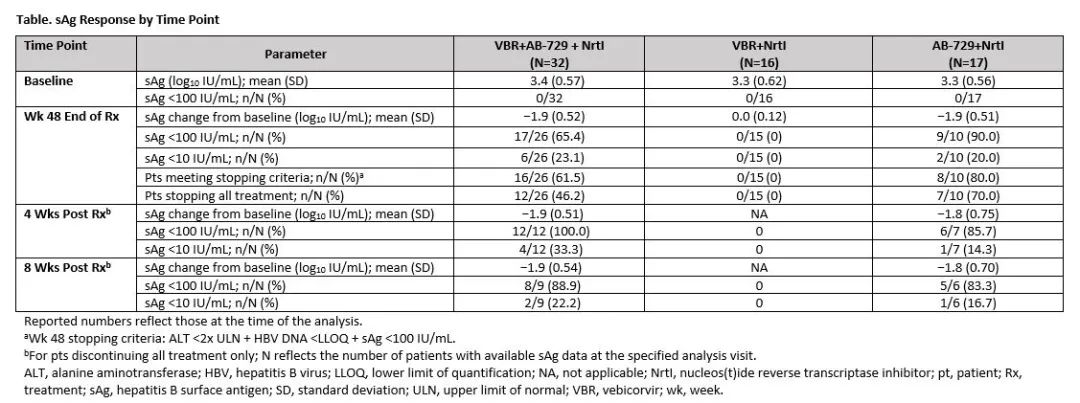
65例病毒抑制的HBeAg阴性CHB患者随机分组,接受VBR+AB-729+NrtI(n=32)、VBR+NrtI(n=16)或AB-729+NrtI(n=17)治疗48周。VBR的用法为300 mg/d,每天口服一次,AB729的用法为每8周皮下注射60 mg。基于治疗48周时的实验室结果,丙氨酸氨基转移酶(ALT)<2倍正常值上限+HBV DNA<定量检测下限(LLOQ)+HBsAg<100 IU/mL的患者可以停用所有治疗药物,进入随访阶段。不符合此停药标准的患者在随访期间继续使用NrtI 单药治疗。病毒学标志物包括HBsAg(Abbott Architect;LLOQ=0.05 lU/mL)和HBV DNA(Cobas TaqMan;LLOQ=20 lU/mL)。根据不良事件和实验室参数,对安全性进行评估。
结果,不同治疗组患者的基线特征相似,治疗的耐受性良好,VBR+AB-729+Nrtl组、VBR+Nrtl组和AB-729+Nrtl组分别有9%(3/32)、6%(1/16)和6%(1/17)的患者由于不良事件而停止治疗。治疗期间的不良事件通常为1/2级,VBR+AB-729+Nrtl组、VBR+Ntl组和AB-729+Nrtl组的不良事件报告率分别为81%(26/32)、75%(12/16)和71%(12/17)。VBR+AB-729+Nrtl组有1例患者发生严重不良事件(新冠肺炎)。
在分析时,虽然没有患者发生HBsAg血清转换,但VBR+AB-729+Ntl组、VBR+Nrtl组和AB-729+Nrtl组具有48周数据的患者分别有16/26、0/15和8/10例符合停止所有治疗的标准。在这些符合停止治疗标准的患者中,VBR+AB-729+NrtI治疗组中的12例患者和AB-729+NrtI治疗组中的7例患者停止了所有治疗。停止所有治疗后8周时,VBR+AB-729+Ntl组和AB-729+Ntl组分别有89%(8/9)和83%(5/6)的患者观察到HBsAg<100 lU/mL的持续抑制。
因此研究者得出结论:病毒抑制的HBeAg阴性CHB患者对VBR、Nrtl和AB-729联合治疗的耐受性良好,现有数据表明,与AB-729+Nrtl治疗相比,AB-729+Nrtl加用VBR联合治疗,并未显著改善治疗期间或治疗后活动性HBV感染的标志物。
02
CHB患者对Toll样受体8激动剂治疗应答的外周单细胞基因表达变化
在本届AASLD年会上,吉列德科学公司Jeffrey Wallin等研究人员报告了CHB患者对Toll样受体8激动剂治疗应答的外周单细胞基因表达变化。
Selgantolimod(SLGN)是一种口服选择性小分子Toll样受体(TLR)8激动剂,具有抗病毒的潜力,已被证明可以安全地用于CHB患者,耐受性良好。通过检测白细胞介素(IL)-12p40和IL-1RA等TLR8通路细胞因子,表明SLGN可以刺激强大的药效反应。研究人员使用单细胞分析技术,对SLGN治疗对外周血单核细胞(PBMC)的分子影响特征进行探讨。
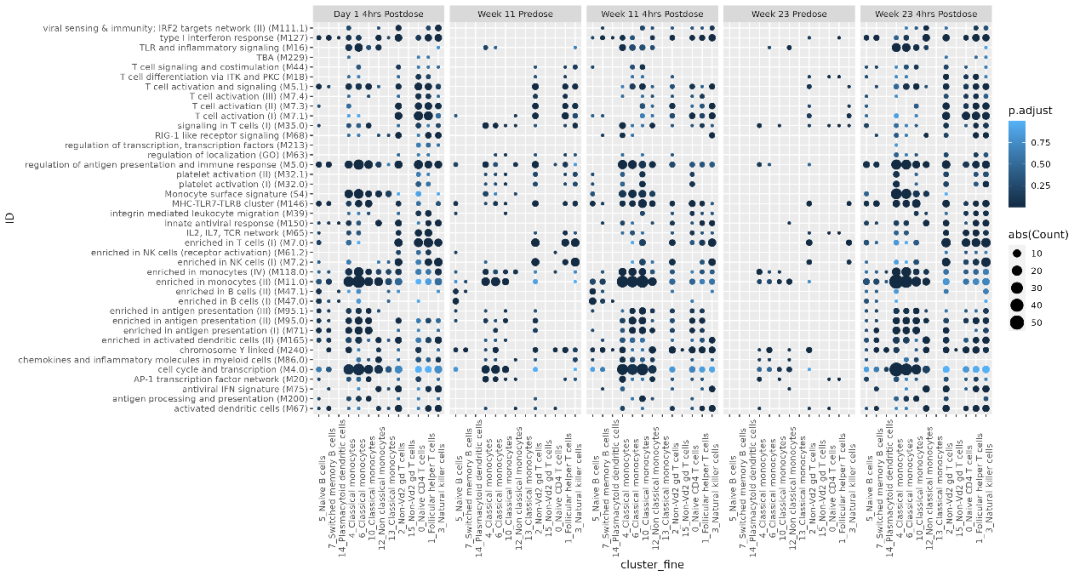
CHB患者接受3 mg SLGN治疗,每周一次,持续24周。在基线、第11周和23周时,对4例参与者采集给药前和给药后4小时的血液样本。使用10X单细胞RNA-seq方法,分离PBMC,评估基因表达,使用Seurat R包进行分析,并使用SingleR识别细胞类型。由非参数Wilcoxon rank sum text,确定基线和治疗不同时间点时基因表达的差异。
结果,通过单细胞基因表达分析,确定了17个细胞集群。使用血液转录模块(BTM)的通路水平分析表明,在不同的治疗时间点,对多个细胞类型发生I型干扰素调控(FDR<0.01)。SLGN治疗后,在包括标注为B细胞、T细胞和NK细胞的几个集群中,诸如IFI144L、STAT1和MX1等干扰素刺激基因上调。此外,研究人员观察到与经典和非经典单核细胞相关的TLR和炎症信号的调控。在经典单核细胞集群确定的许多差异表达基因(DEG)中(FDR <0.05),在给药后4小时的所有时间点,MECP2和FKBP5上调。
据报道,它们的基因产物可以作为免疫细胞中染色质结构和基因表达的调节剂(MECP2),并参与过度干扰素应答的下调(FKBP5)。此外,在非经典单核细胞集群中,研究人员在相同的治疗时间点观察到DEG,与经典单核细胞相比,总体倍数变化差异较低(平均log2倍数变化为0.66对比0.49)。
值得注意的是,与基线相比,观察到初始T细胞DEG的不同动力学。首次应用SLGN后4小时,虽然在初始T细胞集群中观察到数百个DEG,包括STAT3和NFkB通路相关基因,但在随后的治疗时间点,显示总体上DEG较少。
因此研究者得出结论:SLGN治疗CHB患者的单细胞PBMC分析,确定了多种细胞类型基因表达的实质性变化。这些发现为SLGN治疗后的细胞变化提供了更深入的了解,并可能为HBV治愈联合策略的互补机制提供信息。
03
聚乙二醇干扰素可减少核苷(酸)类似物治疗CHB患者应用bepirovirsen治疗后的复发:2b期B-TOGETHER研究结果
在本届AASLD年会上,西班牙Maria Buti等研究人员报告了2b期B-TOGETHER研究结果,聚乙二醇干扰素可以减少核苷(酸)类类似物治疗CHB患者应用bepirovirsen治疗后的复发。
在2b期B-Clear研究(209668)中,bepirovirsen(BPV,一种反义寡核苷酸)300 mg,治疗24周,维持核苷(酸)类似物(NA)治疗的参与者有9%达到持续的HBsAg和HBV DNA转阴[停用BPV治疗后24周,<定量检测的下限(LLOQ)],BPV治疗结束时的应答率更高(26%),但一些患者在随访期间复发。基线HBsAg较低患者的应答率更高(HBsAg≤3000和≤1000 IU/mL患者的应答率分别为12%和16%)。B-Together研究对BPV和聚乙二醇干扰素(PegIFN)序贯治疗是否可以提高在B-Clear中观察到的BPV疗效进行评估。
B-Together是一项2b期、多中心、随机、开放标签的研究。如果接受稳定NA治疗的患者HBsAg>100 IU/mL,HBV DNA<90 IU/mL,ALT≤2倍正常值上限,并且没有应用PegIFN治疗的禁忌证,则符合入选条件。患者被1:1随机分组,接受BPV 300 mg治疗,每周一次(QW,加上第4天和第11天的加载剂量),治疗24周(1组)或12周(2组)。BPV治疗结束后,评估入选资格,接受24周的PegIFN治疗,180 mcg/次,QW,PegIFN治疗结束后,随访24周(1组)或36周(2组)。在整个研究过程中,患者继续应用NA治疗。主要终点为在计划的序贯治疗结束后,没有重新开始抗病毒治疗(挽救治疗)的情况下,HBsAg和HBV DNA<LLOQ维持24周的患者比例,通过监测不良事件,对安全性进行评估。
结果,该研究纳入108例患者(1组55例,2组53例),两组患者的基线特征相似,并且与B-Clear患者的基线特征相似。1组和2组分别有5例(9%)和8例(15%)患者达到主要终点,所有应答者的基线HBAg≤3000 IU/mL。只有BPV应答者可以从Peg-IFN治疗中获益,减少停药后的复发(B-Together和B-Clear的复发率:1组为58%对比63%;2组为0%对比75%)。两组患者发生不良事件的比例相似[1组52例(95%);2组52例(98%)]。8例(7%)患者报告了严重不良事件[BPV治疗期间,5例(5%);PegIFN治疗期间,0例;随访期间,3例(3%)]。BPV对随后序贯PegIFN治疗的安全性并未产生不利影响。
因此研究者得出结论:与单独BPV治疗(B-Clear)相比,BPV和PeglFN顺序治疗,可以减少BPV应答者的复发,从而提高停药后的应答率,没有发现新的令人担忧的安全性问题。
04
对应用VTP-300联合低剂量纳武单抗治疗CHB有效性、安全性、耐受性、免疫原性和治疗方案进行评估的一项2b期、开放标签的研究
在本届AASLD年会上,Henrik Sorensen等报告了一项2b期、开放标签的研究,对应用VTP-300联合低剂量纳武单抗治疗CHB患者的有效性、安全性、耐受性、免疫原性和治疗方案进行评估。
新的治疗观念关注提高CHB的功能性治愈率,目的是停用核苷(酸)类似物(NA),没有病毒学复发或肝病进展的风险,并进一步降低肝细胞癌(HCC)的风险。诱导CD8+T细胞对HBV的应答,可能是实现功能性治愈的必要机制。VTP-300是一种抗原特异性的研究性免疫治疗,由黑猩猩腺病毒(ChAdOx1)初免和改良的安卡拉牛痘病毒(MVA)加强所组成,递送与HBV感染相关的抗原。此前对54名患者的1b/2a期研究表明,VTP-300作为单一药物,以及和低剂量纳武单抗(LDN)联合治疗,可获得有意义和持续的HBsAg应答。该项研究将探讨不同的给药时机和增强方案,以进一步优化HBsAg下降的疗效。
2b期试验正在招募120名CHB患者(3组,每组各40名患者),在筛查前,患者接受NA治疗至少6个月,HBV DNA病毒载量≤1000 IU/mL,HBsAg为10~4000 IU/mL。第1组在第29天应用ChAdOx1-HBV(2x10*10病毒颗粒),接着应用MVA-HBV(1x10*8 pfu)和LDN(0.3 mg/kg IV);第2组在第29天应用ChAdOx1-HBV(2x10*10病毒颗粒),接着应用MVAHBV(1x10*8 pfu)和LDN(0.3 mg/kg IV),然后,在第85天应用MVAHBV(1x10*8 pfu)和LDN;第3组在第29天应用ChAdOx1-HBV(2x10*10病毒颗粒),接着应用MVA-HBV(1x10*8 pfu),然后在第36天应用LDN,在第85天应用MVA-HBV(1x10*8 pfu)(仅在HBAg≥10IU/mL时才应用)。主要终点为开始治疗后6个月,HBsAg下降大于1 log的患者比例。在1年的随访期间,通过IFNg ELISpot检测,使用涵盖HBV免疫原的基因型C和D HBV肽,对HBV特异性T细胞应答进行评估。
结果,截至2023年5月22日,已有51名参与者入选HBV003,继续积累疗效和安全性数据。在2023年AASLD年会上,研究人员预计将报告达到第113天的至少50名参与者的数据,显示第二次MVA-HBV加强对HBsAg水平的影响,以及在第36天应用LDN,而不是在MVA-HBV时应用LDN对HBsAg水平的影响。此外,预计至少有40名参与者已达到第169天的时间点,届时将对他们进行停用NA的评估。预计将于2023年12月完成患者入选,最终结果将于2025年初公布。
因此研究者得出结论:VTP-300是一种新型抗原特异性的研究性免疫治疗,作为单药治疗以及与LDN联合治疗,已经显示(在1b/2a期研究中)可以使CHB患者获得有意义和持续的的HBsAg下降。评估PD-1抑制剂的加用和给药时机以及MVA-HBV的二次加强,对于优化VTP-300方案至关重要,可望成为CHB功能性治愈方案的重要组成部分。
05
CHB患者应用JNJ73763989(JNJ-3989)和核苷(酸)类似物治疗后肝内病毒和免疫标志物的变化:INSIGHT第40周中期结果
在本届AASLD年会上,意大利Pietro Lampertico等研究人员报告了INSIGHT第40周的中期结果,对CHB患者应用JNJ73763989(JNJ-3989)和核苷(酸)类似物(NA)治疗后肝内病毒和免疫标志物的变化进行评估。
CHB患者应用JNJ-3989和NA±JNJ-6379治疗,可使血清HBV标志物大幅下降。INSIGHT研究对CHB患者应用基于JNJ-3989的治疗后,肝内病毒和免疫标志物的变化进行评估。
INSIGHT是一项2期多中心研究,纳入目前尚未接受治疗的HBeAg阳性CHB患者(第1组)或应用NA后,病毒得到抑制的HBeAg阴性CHB患者(第2组)。患者接受48周的JNJ-3989+NA治疗(±JNJ-6379退出研究)。在基线和第40周时,使用标准化程序,收集配对的肝穿活检标本,对肝内病毒和免疫标志物的变化进行评估。
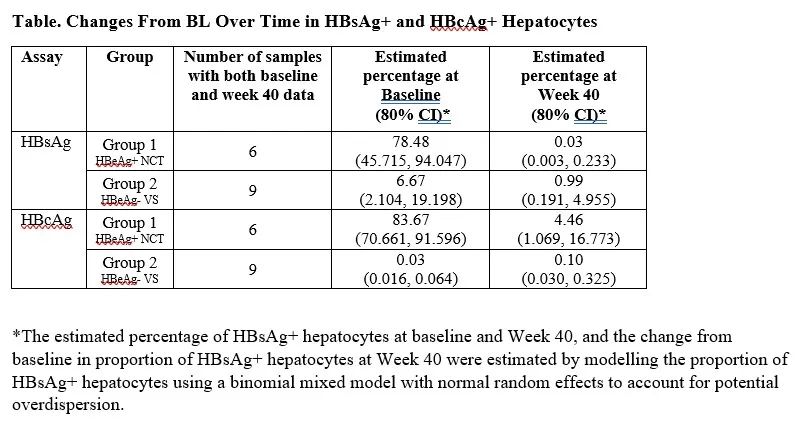
结果,基线时,第1组参与者的病毒血清标志物水平高于第2组。应用JNJ-3989治疗40周时,和基线相比,第1组和第2组的HBsAg水平分别下降3.78±0.481和2.40±0.160 log10 IU/mL。第1组9例患者中的1例(11.1%)在第40周时获得HBsAg血清清除。40周时,两组估算的HBsAg+肝细胞平均百分比均有下降,相比之下,仅在第1组中,HBcAg+细胞的平均百分比有所下降。第1组HBV RNA+肝细胞的百分比从基线时的90.2%~100%降至40周时的4.4%~28.4%,第2组HBV RNA+肝细胞的百分比从基线时的8.6%~31.6%降至40周时的5.6%~15%(每组均有4名患者具有基线和40周时的配对肝穿标本)。
在JNJ-3989治疗期间,第1组的cccDNA-/HBV RNA-细胞百分比从基线时的0~1.2%增至40周时的48.1%~68.9%,第2组的cccDNA-/HBV RNA-细胞百分比从基线时的31.3%~64.8%增至40周时的51.1%~66.7%(每组均有4名患者具有基线和40周时的配对肝穿标本)。对肝穿活检标本进行分析发现,40周时,第1组的早期激活CD8+T细胞发生富集,第2组的CD8+耗竭T细胞、CD8+效应记忆T细胞和CD8+记忆干细胞发生消耗。
因此研究者得出结论:CHB患者应用JNJ-3989治疗40周时,HBsAg+肝细胞减少,未受感染肝细胞的比例增加。肝内CD8+T细胞在治疗期间发生了变化(第1组早期激活的CD8+T细胞增加,第2组的耗竭T细胞消耗,表明JNJ-3989+NA联合治疗可以引起肝内适应性免疫的激活。
06
鼻腔应用含有HBsAg和HBcAg混合黏膜吸附性CVP的治疗性疫苗,可使慢性HBV感染患者的HBsAg长期下降:48个月的随访结果
在本届AASLD年会上,日本爱媛大学Osamu Yoshida等研究人员报告了慢性HBV感染患者鼻腔应用含有HBsAg和HBcAg混合黏膜吸附性CVP的治疗性疫苗的48个月随访结果。
研究人员报告了一种鼻腔应用治疗性疫苗,含有HBsAg/HBcAg与黏膜吸附辅料羧基乙烯基聚合物(CVP-NASVAC),可以使慢性HBV感染患者的HBsAg水平下降。该项研究对应用10剂CVP-NASVAC后48个月的长期疗效进行评估。
在日本爱媛大学医院进行的开放标签的该项临床试验获得机构审查委员会(CRB#18EC003)的许可,经过日本jRCT临床试验机构注册(#jRCTs061180100),纳入慢性HBV感染患者,参与者签署知情同意书后,应用CVP-NASVAC治疗10次,每2周一次,在至少12个月的时间间隔后,一些患者应用额外的10剂CVP-NASVAC治疗。对应用前10剂CVP-NASVAC后48个月的数据进行分析。
结果,72名患者参加了该项研究,61名参与者完成了48个月的随访,对完成48个月随访参与者的数据进行分析。在研究期间,25名参与者继续应用核苷(酸)类似物(NA)治疗,40名参与者应用额外的10剂CVP-NASVAC治疗。在应用前10剂CVP-NASVAC后48个月,85.2%(n=52/61)的患者表现出HBsAg较基线下降,平均HBsAg下降40.3%(0.4352 Log IU/mL)。
值得注意的是,8名参与者获得HBsAg清除。70.5%(43/61)的患者诱导产生抗-HBs。应用CVP-NASVAC治疗后,HBcAg特异性细胞毒性T淋巴细胞(CTL)增加。在48个月的随访期间,9名患者中的3名获得HBeAg清除。基线时检测到HBcrAg的所有24名参与者都观察到HBcrAg下降。
因此研究者得出结论:慢性HBV感染患者应用CVP-NASVAC治疗后,表现出长期的HBsAg下降和清除,CVP-NASVAC可望成为慢性HBV感染患者的新型免疫疗法。
参考文献:
[1] MacQuillan G, Elkhashab M, Antonov K, et al. Preliminary off-treatment responses following 48 weeks of vebicorvir, nucleos(t)ide reverse transcriptase inhibitor, and AB-729 combination in virologically suppressed patients with hepatitis b e antigen negative chronic hepatitis b: analysis from an open-label phase 2 study. AASLD 2023. Oral 47.
[2] McDonald C, Downie B, Sowah LA, et al. Peripheral single cell gene expression changes in response to toll-like receptor 8 agonist treatment in chronic hepatitis b patients. AASLD 2023. Oral 48.
[3] Heo J, Tanaka Y, Andreone P, et al. Pegylated interferon reduces relapses following bepirovirsen treatment in participants with chronic hepatitis b virus infection on nucleos(t)ide analogues: end of study results from the phase 2b b-together study. AASLD 2023. Oral 49.
[4] Sorensen H, Evans T, Bussey L, et al. A phase 2b, open-label study to evaluate the efficacy, safety, tolerability, immunogenicity and treatment regimens of vtp-300 combined with low-dose nivolumab in chronic hepatitis b infection. AASLD 2023. Oral 50.
[5] Asselah T, Gane EJ, Fung SK, et al. Intrahepatic changes in viral and immune markers following treatment with JNJ-73763989 (JNJ-3989) and nucleos(t)ide analogs (NAs), in patients with chronic hepatitis b (CHB): insight week 40 (w40) interim results. AASLD 2023. Oral 51.
[6] Shiraishi K, Imai Y, Sanada T, et al. Long term HBsAg reduction by a nasal administrative therapeutic vaccine containing HBsAg and HBcAg mixed with mucoadhesive CVP in patients with chronic HBV infection: the results of 48 months follow up. AASLD 2023. Oral 52.
会场花絮



声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
研究
热点聚焦
乙肝
发表评论
全部评论