当前位置:EASL-欧洲肝脏研究协会年会 » 正文
EASL2022丨盘点:乙肝新药研究进展(一)
—— 作者: 时间:2022-06-25 07:15:37 阅读数:
166
慢性乙型肝炎(CHB)是全球重大健康问题,影响近3亿人。HBV生命周期的每个阶段都可能是治疗靶点。现行治疗策略主要从抑制病毒复制、减少病毒抗原负荷、增强免疫应答三方面着手,可能需要多种药物联合使用提高功能性治愈率。目前有超过50种新药处于不同开发阶段,超过25种药物已超过I期试验,相关结果引人关注。
第57届欧洲肝病研究学会年会(EASL2022)暨2022年国际肝脏大会TM(ILC 2022)上,多款乙肝在研新药的最新中期研究数据公布,包括siRNAs药物JNJ-3989、VIR-2218和CAM药物JNJ-6379,PD-LI抗体ASC22(Envafolimab),治疗性疫苗JNJ-0535以及新型ASPIN ATI-2173等。《国际肝病》特此报道,研究摘要内容分享如下。
01
GS010:siRNA JNJ-3989和CAM JNJ-6379有限治疗HBeAg阴性病毒抑制慢乙肝患者48周的疗效和安全性:REEF-2研究结果
小干扰RNA(siRNAs) 药物JNJ-3989通过靶向HBV RNA,减少HBV蛋白合成。衣壳组装调节剂(CAM)JNJ-6379通过诱导空病毒颗粒形成以抑制病毒复制。REEF-2研究评估了JNJ-3989 200 mg SC Q4W、JNJ-6379 250 mg PO QD和核苷(酸)类似物(NA)PO QD对HBeAg阴性CHB患者的疗效和安全性。
这项IIb期、双盲、多中心、安慰剂对照研究中,HBsAg>100 IU/mL且NA治疗≥2年的非肝硬化HBeAg阴性CHB患者以2:1随机分入加用JNJ-3989 + JNJ-6379组或安慰剂组。48周后停止包括NA在内的所有治疗。主要终点是随访第24周不重启NA治疗达到HBsAg<0.05 IU/mL的患者比例。本届EASL年会上报告第48周的中期数据。
结果共分析130例患者(治疗组85例,对照组45例;男性占比67%,亚裔占比20%,平均年龄46岁)。基线时两组分别有80%和76%的患者HBsAg≥1000 IU/mL(均值分别为3.4 log 10和3.5 log 10 IU/mL),既往使用NA的平均持续时间分别为8.4年和8.1年。
治疗结束时,两组HBsAg自基线降低均值分别为-1.89(0.060)和-0.06(0.012)log 10 IU/mL。治疗组亚裔(N=15)和非亚裔患者(N=61)HBsAg下降分别为-2.05(0.52)和-1.85(0.52)log 10 IU/mL。治疗结束时,治疗组HBsAg<100、< 10、< 1 IU/mL的患者分别占71.1%、19.7%和2.6%;对照组比例分别为2.4%、0%和0%;两组患者均未达到HBsAg血清学清除。
两组分别有81.2%和71.1%的患者发生不良事件(AE),其中3级或4级AE分别为15.3%和4.4%。7.1%的治疗组患者出现3级eGFR事件。治疗开始后,治疗组中观察到eGFR降低,在后续治疗中无进展。两组分别有2例和1例患者发生严重AE,但无一被认为与研究药物有关。两组治疗中断率分别为3.5%和2.2%;未发生导致死亡的不良事件。
研究表明,与安慰剂+NA相比,JNJ-3989 + JNJ-6379 + NA治疗48周可使HBsAg水平降低更多,整体安全性和耐受性良好。
02
OS090:siRNA VIR-2218治疗持续时间越长,CHB患者HBsAg降低程度越深、持续时间越长
VIR-2218是一种开发中的siRNA治疗剂,靶向HBV基因组X区。这项正在进行的研究评估了CHB患者使用2种剂量方案的VIR-2218的安全性、耐受性和抗病毒活性。
这项开放标签的Ⅱ期试验纳入病毒抑制、HBeAg阳性或阴性、无肝硬化的慢性CHB成人患者。给药方案分别为每4周皮下注射2剂(N=6)或6剂(N=15)200mg VIR-2218。本次报告截至最终随访时的2剂(第48周)和6剂(第44周)方案数据。
接受2剂方案的6例受试者中有5例完成了第48周的研究,接受6剂方案的15例受试者中有7例完成了第44周的研究。所有受试者HBsAg降低程度超过1个对数级。与2剂方案相比,6剂方案与平均最大HBsAg降低更大(-1.96对-1.61 log10 IU/ml)和HBsAg降低持续性更强(第44周:-1.76对-0.87 log10 IU/ml)相关(图1)。两组AE主要为1级或2级,无AE导致停用研究药物。大多数受试者在整个研究过程中ALT水平正常;两组分别有2例受试者出现1级ALT升高。未发生治疗相关的严重AE。
初步数据表明,VIR-2218治疗持续时间越长,HBsAg降低程度越深,持续时间越长。2个剂量方案未观察到安全性或耐受性的差异。
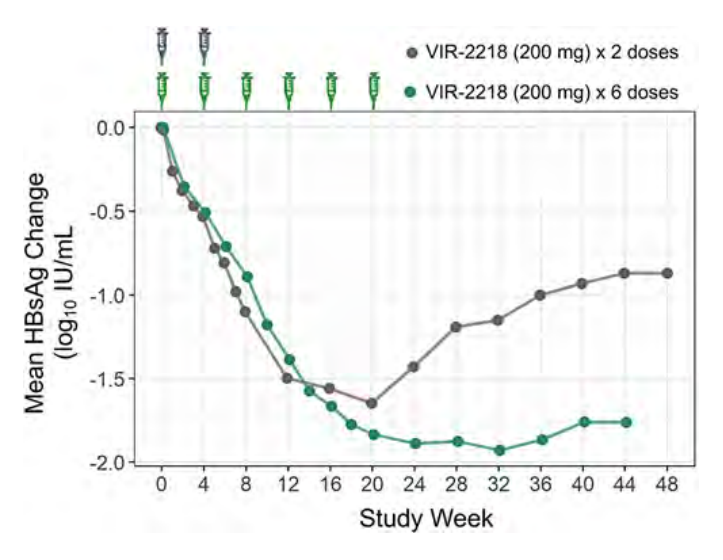
图1. 2个剂量方案的HBsAg变化曲线
03
OS091:ALT水平骤升与HBsAg降低、清除/转换相关:一项CHB患者使用PD-L1抗体ASC22 (Envafolimab)与NA治疗24周的IIb期试验中期结果
阻断PD-1/PD-L1信号通路可恢复T细胞功能,并有可能实现CHB功能性治愈。肝炎暴发被认为主要由免疫介导,可能与HBsAg降低甚至清除有关。既往研究表明,免疫调节剂Peg-IFN治疗可能导致18%~24%的患者ALT水平骤升。直接抗病毒药物siRNA引起低至6%的患者ALT骤升。这项研究评估了ALT骤升的特征及其与HBsAg降低、清除与转化的关系。
这项随机、单盲、多中心IIb期试验共纳入149例CHB患者(HBeAg阴性,HBsAg≤10000 IU/mL,HBV DNA <20 IU/mL),分入两组进行24周ASC22治疗(1或2.5 mg/kg)和24周随访。在完成24周1 mg/kg ASC22 Q2W+ NAs (N= 33)或24周安慰剂 Q2W+ NAs(N= 11)治疗的患者中,分析ALT突然升高和HBsAg降低/清除之间的关系。ALT骤升定义为ALT一过性升高,超过基线水平3倍、超过ULN 2倍。
两组患者间HBsAg、ALT和AST基线血清水平相似。7例患者HBsAg降低>0.5 log10 IU/mL,所有患者基线HBsAg≤500 IU/mL。3例患者出现HBsAg血清学清除(检测不到,<0.05 IU/mL)。1例HBsAg清除的患者在使用最后一剂ASC22后6周出现HBsAg血清学转换(图2A)。ASC22组中,15%的患者发生ALT骤升,而安慰剂组中未观察到。在HBsAg降低>0.5 log10 IU/mL或HBsAg清除的患者中,分别有57%和67%出现ALT骤升(图2B)。ALT骤升的患者未观察到有临床意义的总胆红素或直接胆红素变化。然而,ASC22组出现更多免疫相关不良事件(irAEs),最常见的irAEs为1级ALT/AST升高和皮疹。
研究表明,在ASC22治疗期间出现ALT骤升是具有临床意义的免疫应答指标,导致HBsAg显著降低和随后的清除/转换。
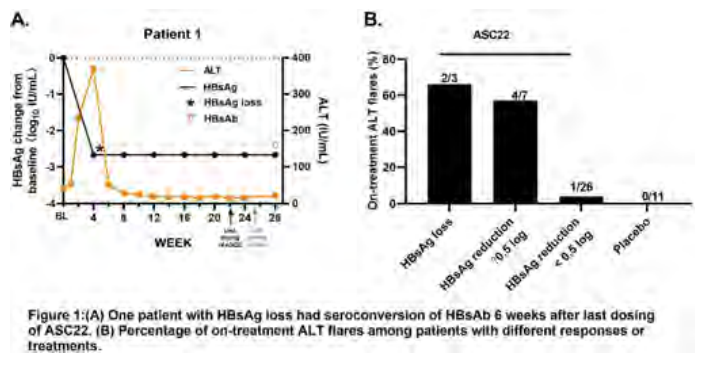
图2.(A)1例HBsAg清除患者在最后一剂ASC22后6周出现HBsAb血清转化;(B)治疗期间不同治疗反应患者出现ALT骤升的比例
04
OS094:治疗性疫苗JNJ-0535在健康成人中诱导强烈的HBV特异性T细胞反应,在CHB患者中诱导中度反应
JNJ-0535是HBV特异性治疗性DNA疫苗,包含编码HBV核心抗原蛋白或聚合酶蛋白的2个质粒。这项研究在健康者和CHB患者中评估JNJ-0535对功能性核心抗原和聚合酶特异性T细胞的诱导作用。
FIH研究64300535HPB1001评估了0.25 mg(N=6)、1 mg(N=7)或6 mg(N=10)的JNJ-0535(含有等量的2种质粒)或安慰剂(N=7),在病毒抑制、HBeAg阴性和稳定NA药物治疗的CHB患者(N=10)中的作用。研究64300535HPB1003在健康受试者(N=12)中评估了6 mg JNJ-0535的作用。通过离体IFN-γ ELISpot和细胞内细胞因子染色(ICS)法,评估基线、疫苗接种期(3剂疫苗后10~14天)和随访期收集的外周血单个核细胞(PBMCs)的功能性核心抗原和聚合酶特异性T细胞反应。
使用6 mg JNJ-0535后,5例CHB患者和11例健康者的核心抗原和(或)聚合酶ELISpot反应自基线增加≥3倍。对两种抗原都有反应的健康者和CHB患者各有6例和0例。与CHB患者(4.8)相比,JNJ-0535疫苗诱导健康者T细胞应答较基线有更高的最大倍数增加(24.4)。总体上,对于ELISpot反应≥150 SFU/百万PBMC的健康者和CHB患者,疫苗诱导的核心抗原特异性CD4+ T细胞是多功能的。多功能核心抗原特异性CD8+ T细胞仅在健康者中被诱导。通过肌内电穿孔递送的JNJ-0535疫苗未发现安全性问题。
研究表明,6 mg JNJ-0535在健康者中诱导的T细胞应答,在应答者比例、自基线增加的倍数、广度(抗原的数量)和CD4+和CD8+核心抗原特异性T细胞多功能性方面优于CHB患者。这一结果验证了这样一种假设,即HBV感染负面影响诱导T细胞对治疗性疫苗的应答能力。
05
OS095:新型ASPIN ATI-2173联合TDF治疗持续12周的抗病毒疗效:一项IIa期临床试验
ATI-2173是一种新型肝靶向的克拉夫定(CLV)氨基磷酸酯前药,为活性位点聚合酶抑制剂核苷酸(ASPIN)。I期试验中,ATI-2173表现出强效的抗HBV活性,停药后4~24周出现持续的治疗后反应。SAVE-1 IIa期试验评估了ATI-2173 +富马酸替诺福韦酯(TDF)在首次治疗的CHB患者中的疗效。
这项随机、双盲、安慰剂对照试验中,每个队列有10例CHB患者,按8:2随机分入每天使用25 mg或50 mg ATI-2173 + TDF组或安慰剂+ TDF治疗组,持续90天。使用Roche cobas 6800分子诊断系统测量HBV DNA和HBV RNA(LLOQ分别=10 IU/mL和10个拷贝/mL)。使用Roche Elecsys测量HBsAg(LLOQ=0.05 IU/mL)。
90%的患者HBeAg阴性。单用TDF(N=4)、25 mg(N=8)和50 mg ATI-2173 + TDF(N=8)的患者,治疗结束时病毒学应答(HBV DNA)自基线的改变分别为-3.53、-3.72和-3.54 log10 IU/mL。未观察到HBsAg的变化。HBV RNA反映了HBV DNA对治疗的反应。在停止治疗12周后,TDF组的病毒载量反应为-0.66,而25 mg和50 mg组分别保持-3.20和-3.50 log10 IU/mL的抑制水平(图3)。在治疗结束12周时,TDF单药组、25 mg和50 mg ATI-2173 + TDF组中分别有0、3和3例患者的HBV DNA<10 IU/mL。随访12周时,ATI-2173 +TDF组的16例受试者中无一重启TDF治疗,相比之下,TDF单药组中有1例在第8周因病毒学复发(HBV DNA >2000 IU/mL)而重启TDF治疗。TDF组观察到治疗后ALT突然升高,ATI-2173组中没有这一现象。
研究表明,在25mg和50mg ATI-2173 + TDF组中观察到相似的治疗期间和治疗后抑制病毒复制的作用。停药后,与单用TDF相比,ATI-2173 + TDF治疗延长了对HBV DNA的抑制作用和病毒学反弹时间,且未发生ALT骤升现象。
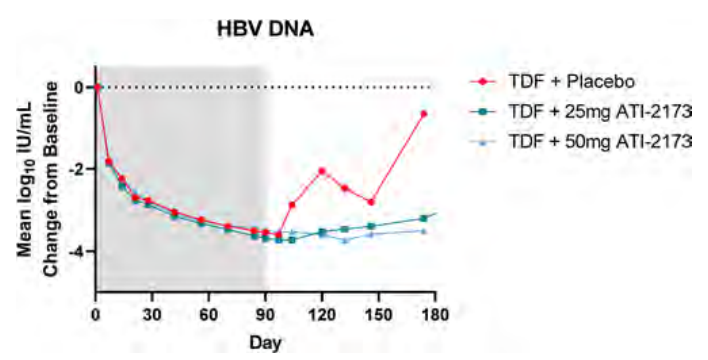
图3.HBV DNA自基线的改变
参考文献:
1. Kosh Agarwal et al. Efficacy and safety of finite 48-week treatment with the siRNA JNJ-3989 and the capsid assembly modulator (CAM-N) JNJ-6379 in HBeAg negative virologically suppressed (VS) chronic hepatitis B (CHB) patients:results from REEF-2 study. EASL2020. Abstract GS010.
2. Young-Suk Lim et al.Longer treatment duration of monthly VIR-2218 results in deeper and more sustained reductions in hepatitis B surface antigen in participants with chronic hepatitis B infection EASL2020. Abstract OS090.
3. Guiqiang Wang et al.ALT flares were linked to HBsAg reduction, seroclearance and seroconversion:interim results from a phase IIb study in chronic hepatitis B patients with 24-week treatment of subcutaneous PD L1 Ab ASC22 (Envafolimab) plus nucleos (t)ide analogs. EASL2020. Abstract OS091.
4. An De Creusc et al. Therapeutic vaccine JNJ-0535 induces a strong HBV-specific T-cell response in healthy adults and a modest response in chronic HBV infected patients. EASL2020. Abstract OS094.
5. Myreen Tomas et al. Sustained 12 week off treatment antiviral efficacy of ATI-2173, a novel active site polymerase inhibitor nucleotide, combined with tenofovir disoproxil fumarate in chronic hepatitis B patients, a phase 2a clinical trial. EASL2020. Abstract OS095.

往期推荐
标签:
研究
热点聚焦
乙肝
发表评论
全部评论