当前位置:FLD-中国脂肪性肝病专题研讨会 >> 正文
[FLD视点]马雄教授:免疫代谢与非酒精性脂肪性肝病
—— 作者:黄冰源 李艳梅 马雄 时间:2017-08-15
阅读数:
432

编者按:免疫代谢是近两年的热点话题,性别、感染因素、肥胖饮食、年龄等都对免疫细胞代谢产生很重要的影响,而非酒精性脂肪性肝病(NAFLD)的代谢问题非常明确,所以在NAFLD领域探讨免疫代谢问题较具前景。“第七届全国脂肪性肝病学术会议”期间,上海交通大学医学院附属仁济医院消化内科马雄教授应大会邀请,从免疫代谢角度,讨论了NAFLD的发病机制,详见下文。
免疫代谢可分为两个部分:一是免疫细胞作用于脂肪组织及肝脏等器官调节全身的代谢;另一方面则是免疫细胞内代谢通路可调节免疫反应。
对免疫学家来说,应注意糖酵解、三羧酸循环、脂代谢、氨基酸代谢等多种代谢途径在不同免疫细胞中所起的调节功能不同。Norata GD等提出饮食和肠道菌群可显著影响从系统到细胞不同层面的“免疫-代谢对话”,通过营养物质和特定代谢产物激活相关代谢诱导信号调节免疫细胞分化以促进免疫系统稳态,代谢微环境可对免疫细胞重编程,使调节性和效应性两种表型的免疫细胞表现出具有一定“可塑性”,进而参与感染及自身免疫相关炎症过程的调节。这类发现可为研究免疫相关疾病的治疗打开机会之窗。
肝脏的“免疫-代谢对话”:
肝脏作为一个免疫和代谢器官,免疫代谢受到体内白色/褐色脂肪组织分泌的TNF、IL-6等细胞因子和脂肪酸、脂联素、瘦素等激素调节。在肥胖情况下,此类因子的分泌异常可导致巨噬细胞浸润。新近研究除了关注炎症因子参与氧化应激、脂质过氧化等过程外,更多的是探究了肠道来源的内毒素、炎症因子、营养物质及代谢物作用于免疫细胞引起的天然/适应性免疫反应变化。
其中肠道菌群更是一大研究热点,如Plovier H等发现给予小鼠模型口服Akkermansiamuciniphila菌可预防肥胖-代谢综合征-NAFLD,对Akk菌进行低温巴氏消毒,结果其减轻炎症、减少小鼠脂肪堆积、胰岛素抵抗和血脂异常的能力反而得到提高;并进一步发现从Akk菌外膜分离出的Amuc-1100蛋白可与TLR2互作,改善肠道上皮紧密连接相关屏障功能,单独行使细菌的部分益生功能。
NAFLD的炎症免疫调控:
非酒精性脂肪性肝病的“二次打击”学说提出,胰岛素抵抗(IR)引起血液游离脂肪酸(FFA)浓度上升导致过量脂肪沉积于肝脏,导致炎症免疫调控的异常而进展至NASH,并可进一步向肝纤维化、肝硬化甚至肝癌发展(图1)。
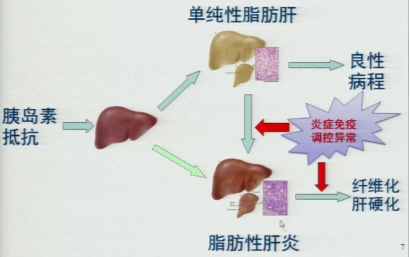
图1.“二次打击”学说示意图
对于NASH进展过程中的炎症免疫调控,巨噬细胞占重要作用。“我们课题组曾关注并发现高脂饮食和内毒素血症情况下肝细胞释放促炎因子CCN1趋化巨噬细胞,加重肝内的炎症。”肝脏受到外界刺激(细菌、病毒、药物、代谢产物等)后,TLR和NLR通过识别病原相关分子模式(PAMP)及危险相关分子模式(DAMP),激活下游的 MyD88诱导肝脏中的巨噬细胞(包括原有的Kuffer细胞和趋化进入肝脏的单核细胞等)发生扩增并产生大量细胞因子,如TNF、IL-6、IL-10及CXC趋化因子配体(CXCL)10等。
TLR4作为TLR家族中的一员,为免疫细胞表面识别PAMP的一个识别受体,也是LPS的受体,能够诱导Kuffer细胞等产生多种细胞因子。在NAFLD发病机制中,表达TLR4的肝细胞持续暴露于肠源性LPS下,通过MyD88-NF-κB通路,诱导后续炎症反应,增加肝细胞损伤,而凋亡肝细胞又可开启DAMP形成恶性循环。与此类似的,在高脂饮食肥胖状态下脂肪细胞表面NK细胞激活受体NCR1的配体上调,刺激NK细胞增殖和或IFN-γ产生,使得免疫细胞向促炎方向分化。NK细胞、NCR1或IFN-γ的缺失可减轻促炎性巨噬细胞积累并可改善胰岛素敏感性。
“我们早期发现高脂饮食时肝内NKT细胞显著减少,肠道益生菌通过增加肝内NKT细胞可缓解胰岛素抵抗和肝细胞脂肪变性,另外我们也发现高脂饮食引起肝内氧应激诱导Treg细胞凋亡,进而使得效应性T细胞及炎症因子失控导致肝细胞损伤,且这一机制与Treg细胞Bcl-2表达水平较低有关。”
初始T细胞向Treg/Th17的分化是一个相互平衡的过程,改变脂肪酸合成通路后,细胞亚群会发生显著的变化。通过抑制脂肪酸合成的关键酶ACC-1,使初始T细胞更多地向CD4调节性T细胞(Treg)方向发展,而在脂肪酸合成功能正常情况下,则更多地向Th17细胞亚群分化。树突状细胞内的脂肪含量也影响该细胞向促炎还是抑炎方向发展。
此外有研究报道肥胖情况下肝细胞内UR1因子增多诱导DNA损伤,导致Th-17、IL-17A增多,加重了肝内胰岛素抵抗,加剧NASH甚至进展至肝细胞癌,可见肝细胞与免疫细胞间存在活跃的免疫代谢对话。而Ma C等发表在《Nature》的研究也指出:肝细胞在能量过剩情况下代谢产生过多的亚油酸,后者作用于CD4+T细胞引起其线粒体增大、氧应激增强导致线粒体功能障碍。使用抗氧化制剂可以阻断这一选择性的CD4+T细胞的缺失,从而缓解炎症甚至阻断肝细胞癌的发生。
小结:
简言之,肝内免疫代谢异常是单纯脂肪肝向NASH和肝纤维化进展的关键事件,天然免疫细胞特别是巨噬细胞(M1/M2转化)等在肠-肝对话中发挥重要作用;适应性免疫应答失衡(Treg/Th17细胞,CD4/CD8细胞等)导致肝内炎症级联反应。不同的免疫细胞功能与独特的代谢配置相关,免疫细胞的代谢状态可以进行重编程,进而导致特性和功能改变。“因此如果能够精细调控机体免疫代谢状态可缓解肝内炎症反应、减轻肝细胞损伤和纤维化甚至肝癌发生。”
标签:
循证视点
脂肪肝
发表评论
全部评论
